解答题-实验探究题 较难0.4 引用2 组卷176
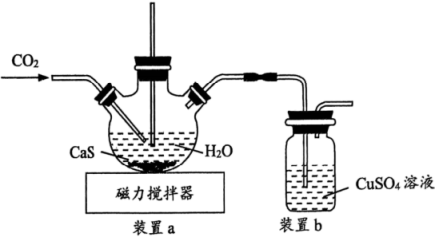
实验室模拟“高炉煤气”(主要成分为: 、
、 、
、 )和金属冶炼厂尾气(含
)和金属冶炼厂尾气(含 )为原料制备硫代硫酸钠晶体
)为原料制备硫代硫酸钠晶体 ,其部分实验过程如下:
,其部分实验过程如下: 和
和 常温下的电离平衡常数分别为:
常温下的电离平衡常数分别为: ,
, ;
; ,
, ;
;
(1)用70%硫酸和亚硫酸钠固体制取 ,而不是用10%的稀硫酸的原因是
,而不是用10%的稀硫酸的原因是___________ 。
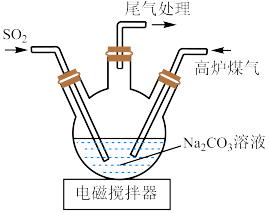
(2)三颈烧瓶中制取 分两步进行,
分两步进行, 与
与 溶液反应,
溶液反应, 再与它们反应的产物反应,得到
再与它们反应的产物反应,得到 。
。
① 与
与 溶液发生反应的离子方程式为:
溶液发生反应的离子方程式为: 。该反应的平衡常数
。该反应的平衡常数
___________ 。
②写出三颈烧瓶中得到 的化学方程式
的化学方程式___________ 。
(3)尾气中含有大量 气体,可用醋酸亚铜氨溶液吸收,反应的方程式为:
气体,可用醋酸亚铜氨溶液吸收,反应的方程式为:

①研究发现尾气中过量 会导致溶液吸收
会导致溶液吸收 的能力下降,原因是
的能力下降,原因是___________ 。
②写出吸收液再生的一种方法:___________ ,同时释放 ,达到资源化利用。
,达到资源化利用。
(4) 也可通过在溶液中发生下列反应制得:
也可通过在溶液中发生下列反应制得: 。补充完整制取
。补充完整制取 晶体的实验方案:称取
晶体的实验方案:称取 硫粉置于
硫粉置于 烧杯中,加少量乙醇使其湿润,再称取
烧杯中,加少量乙醇使其湿润,再称取 亚硫酸钠固体置于同一烧杯中,
亚硫酸钠固体置于同一烧杯中,___________ 。(实验中还需要使用的试剂有:乙醇、蒸馏水。)已知: 不溶于乙醇,其在水中的溶解度如下表:
不溶于乙醇,其在水中的溶解度如下表:
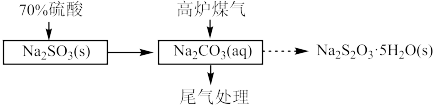
(1)用70%硫酸和亚硫酸钠固体制取
(2)三颈烧瓶中制取
①
②写出三颈烧瓶中得到
(3)尾气中含有大量
①研究发现尾气中过量
②写出吸收液再生的一种方法:
(4)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 |
| 溶解度/g | 50.2 | 59.7 | 70.1 | 83.2 | 104 |
23-24高三下·江苏·阶段练习
类题推荐
FeS是一种黑色固体,常用作固体润滑剂、废水处理剂等。可通过高温合成法和均相沉淀法合成纳米FeS。
Ⅰ.高温合成法
称取一定质量还原铁粉和淡黄色硫粉,充分混合后置于真空密闭石英管中。用酒精喷灯加热。加热过程中硫粉升华成硫蒸气。持续加热至反应完全,冷却,得纳米FeS。
(1)若分别用S8和S6与足量铁粉反应制取等质量的FeS,消耗S8和S6的质量比为___________ 。
(2)反应需在真空环境下进行的原因是___________ 。
Ⅱ.均相沉淀法
实验室以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]和硫代乙酰胺(CH3CSNH2)为主要原料,利用如图装置合成纳米硫化亚铁的流程如下:
CH3CSNH2+2H2O+H+=CH3COOH+H2S+NH ;
;
CH3CSNH2+3OH-=CH3COO-+S2-+NH3·H2O。
(3)加入药品前检查装置气密性的操作为___________ 。
(4)“反应”时,控制混合液pH约为9,温度70℃。三颈烧瓶内发生反应的离子方程式为___________ 。
(5)该方法得到的产品中常混有少量Fe(OH)2杂质。有研究表明,在混合液中添加少量柠檬酸钠(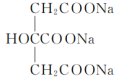 )可降低溶液中c(Fe2+),抑制Fe(OH)2杂质的形成。加入柠檬酸钠能降低c(Fe2+)的原因是
)可降低溶液中c(Fe2+),抑制Fe(OH)2杂质的形成。加入柠檬酸钠能降低c(Fe2+)的原因是___________ 。
(6)已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于乙醇。下表列出了不同温度下硫酸铵、硫酸亚铁、硫酸亚铁铵在水中的溶解度:
请补充完整实验室制取硫酸亚铁铵晶体的实验过程:取4.0g充分洗净的铁屑,___________ ,趁热过滤,洗涤、烘干,得未反应铁屑1.2g。向滤液中___________ ,低温烘干,得到硫酸亚铁铵晶体。[可选用的实验试剂有(NH4)2SO4晶体、3mol·L-1H2SO4溶液、0.1mol·L-1H2SO4溶液、蒸馏水、无水乙醇]
Ⅰ.高温合成法
称取一定质量还原铁粉和淡黄色硫粉,充分混合后置于真空密闭石英管中。用酒精喷灯加热。加热过程中硫粉升华成硫蒸气。持续加热至反应完全,冷却,得纳米FeS。
(1)若分别用S8和S6与足量铁粉反应制取等质量的FeS,消耗S8和S6的质量比为
(2)反应需在真空环境下进行的原因是
Ⅱ.均相沉淀法
实验室以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]和硫代乙酰胺(CH3CSNH2)为主要原料,利用如图装置合成纳米硫化亚铁的流程如下:


CH3CSNH2+2H2O+H+=CH3COOH+H2S+NH
CH3CSNH2+3OH-=CH3COO-+S2-+NH3·H2O。
(3)加入药品前检查装置气密性的操作为
(4)“反应”时,控制混合液pH约为9,温度70℃。三颈烧瓶内发生反应的离子方程式为
(5)该方法得到的产品中常混有少量Fe(OH)2杂质。有研究表明,在混合液中添加少量柠檬酸钠(
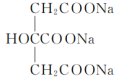 )可降低溶液中c(Fe2+),抑制Fe(OH)2杂质的形成。加入柠檬酸钠能降低c(Fe2+)的原因是
)可降低溶液中c(Fe2+),抑制Fe(OH)2杂质的形成。加入柠檬酸钠能降低c(Fe2+)的原因是(6)已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于乙醇。下表列出了不同温度下硫酸铵、硫酸亚铁、硫酸亚铁铵在水中的溶解度:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 70℃ | |
| (NH4)2SO4 | 73.0g | 75.4g | 78.0g | 81.0g | 84.5g | 91.9g |
| FeSO4·7H2O | 40.0g | 48.0g | 60.0g | 73.3g | - | - |
| (NH4)2SO4·FeSO4·6H2O | 18.1g | 21.2g | 24.5g | 27.9g | 31.3g | 38.5g |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网