解答题-原理综合题 较难0.4 引用2 组卷62
I.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,反应为
 ,
, 。请回答下列问题:
。请回答下列问题:
(1)常温下,合成氨反应________ (填“能”或“不能”)自发进行,其平衡常数表达式K=________ 。
(2)________ 温(填“高”或“低”)有利于提高反应速率,________ 温(填“高”或“低”)有利于提高平衡转化率,综合考虑催化剂活性等因素,工业常采用400∼500℃。
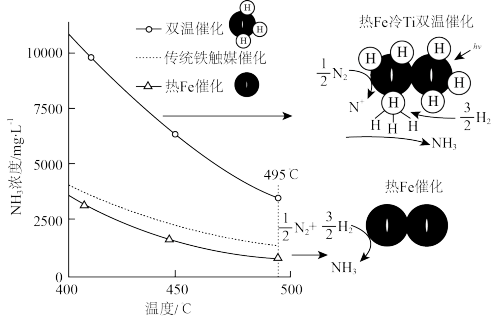
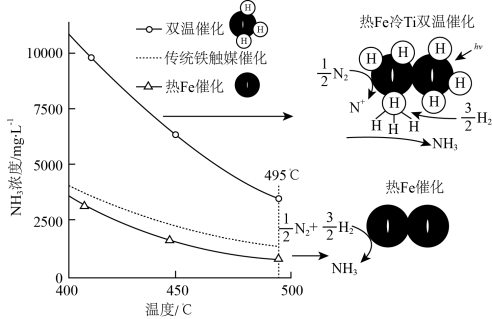
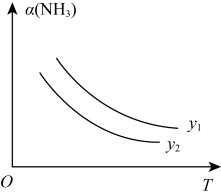
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2·xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2·xHy的温度为415℃)。(纵坐标为反应达平衡时NH3的浓度)________________ 。
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下: ,
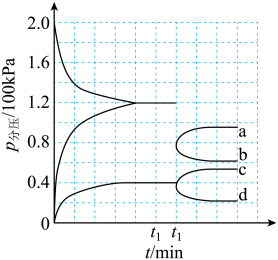
, ,恒容容器中,对于以上反应,能加快反应速率的是
,恒容容器中,对于以上反应,能加快反应速率的是________ 。
A.升高温度 B.充入He C.加入催化剂
(5)已知 ,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成
,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成________ 吨尿素。
Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:________ ;
(7)在b点,溶液中各离子浓度由大到小的排列顺序是________ ;
(8)在cd段发生反应的离子方程式为________ 。
(1)常温下,合成氨反应
(2)
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2·xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2·xHy的温度为415℃)。(纵坐标为反应达平衡时NH3的浓度)
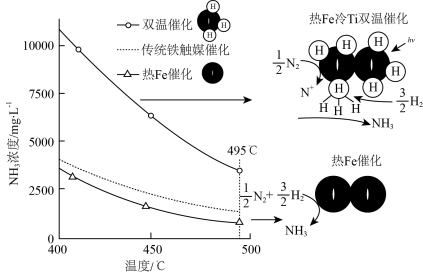
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:
A.升高温度 B.充入He C.加入催化剂
(5)已知
Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
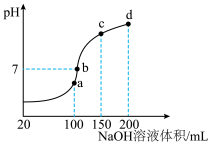
(7)在b点,溶液中各离子浓度由大到小的排列顺序是
(8)在cd段发生反应的离子方程式为
23-24高二下·上海·期中
类题推荐
工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为: 。回答下列问题:
。回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)工业常采用 。针对反应速率与平衡产率的矛盾,我国科学家提出了双温—双控—双催化剂。使用
。针对反应速率与平衡产率的矛盾,我国科学家提出了双温—双控—双催化剂。使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为 时,
时, 的温度为
的温度为 ,而
,而 的温度为
的温度为 )。
)。
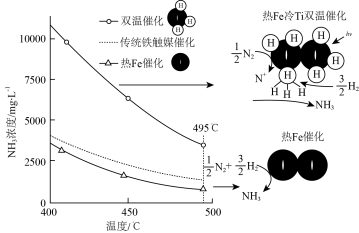
下列说法正确的是___________
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(3)某合成氨速率方程为 ,根据表中数据,
,根据表中数据, =
=___________ 。
(4)工业合成氨基本合成过程如下
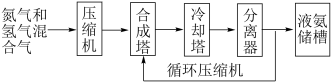
分离器中的过程对整个工业合成氨的意义是___________
(5)氯化银可以溶于氨水,反应原理为 。
。
已知 ,
,
常温时,用 某浓度氨水(溶质视为
某浓度氨水(溶质视为 )完全溶解
)完全溶解 ,所需氨水浓度至少为
,所需氨水浓度至少为_______ 
(1)合成氨反应在常温下
(2)工业常采用

下列说法正确的是
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(3)某合成氨速率方程为
| 实验 | c(N2) | c(H2) | c(NH3) | v/mol·L—1.s—1 |
| 1 | m | n | P | q |
| 2 | 2m | n | P | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | P | 2.828q |
(4)工业合成氨基本合成过程如下

分离器中的过程对整个工业合成氨的意义是
(5)氯化银可以溶于氨水,反应原理为
已知
常温时,用
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网