解答题-实验探究题 适中0.65 引用1 组卷172
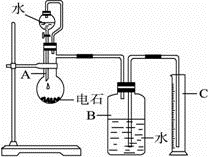
某实验小组设计如图所示实验装置来制取乙炔,并粗略测定电石(含有N、P、S等元素)中碳化钙的质量分数。回答下列问题:_________ 。
(2)仪器b中发生反应的化学方程式为_________ ,实验过程中为了减缓水与电石的反应速率,可采取的措施是_________ (写一条即可)。
(3)将生成的气体通入酸性KMnO4溶液中,观察到酸性KMnO4溶液褪色。
①_______ (填“能”或“不能”)说明生成的气体全部为乙炔,原因是______ 。
②实验小组发现该实验不能用启普发生器来制取乙炔,理由是______ (写一条即可)。
(4)为了安全,点燃乙炔前应_______ ,乙炔燃烧时的现象是____________ 。
(5)取mg电石样品,使其与水完全反应,实验结束后测得排入量筒中水的体积为VmL,则电石中碳化钙的质量分数为______ (用含V和m的代数式表示,忽略导管中残留的水和气体中含有的水蒸气,所有气体均已换算成标准状况下)。
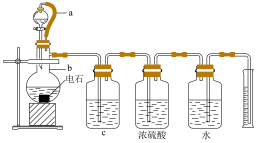
(2)仪器b中发生反应的化学方程式为
(3)将生成的气体通入酸性KMnO4溶液中,观察到酸性KMnO4溶液褪色。
①
②实验小组发现该实验不能用启普发生器来制取乙炔,理由是
(4)为了安全,点燃乙炔前应
(5)取mg电石样品,使其与水完全反应,实验结束后测得排入量筒中水的体积为VmL,则电石中碳化钙的质量分数为
21-22高二上·江西南昌·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网