解答题-原理综合题 较难0.4 引用2 组卷230
工业废气中H₂S的回收利用有重要意义。
I.利用H2S 制CS2。
(1)热解H2S和CH4的混合气体制H2和CS2。
①2H2S(g) =2H2(g)+S2(g) ΔH1=+170kJmol-1
②CH4(g)+S2(g)=CS2(g)+2H2(g) ΔH2=+64kJmol-1
总反应:2H2S(g)+CH4(g) =CS2 (g)+4H2(g),ΔH=___________ 。
(2)CH4的电子式为___________ ,CS2分子的立体构型为___________ 。
(3)工业上还可以利用硫(S8) 与CH4为原料制备 CS2,S8受热分解成气态 S2, 发生反应 2S2(g)+CH4(g) =CS2(g)+2H2S(g), 某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与 CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________
②当以下数值不变时,能说明该反应达到平衡的是___________ (填序号)。
a.气体密度 b. 气体总压 c.CH4 与S2体积比 d.CS2的体积分数
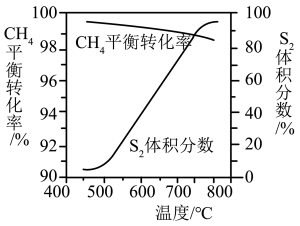
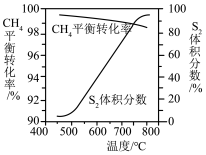
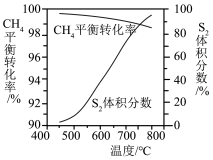
③一定条件下,CH4与 S2反应中 CH2的平衡转化率、S8分解产生 S2的体积分数随温度的变化由线如下图所示,据图分析,生成 CS2的反应为___________ (填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________ 。
(4)回收单质硫。将三分之一的H2S燃烧。产生的SO2与其余H2S混合反应:2H2S(g)+SO2(g)
 S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol/L,c(SO2)=5.0×10-5mol/L,c(H2O)=4.0×10-3mol/L,计算该温度下的平衡常数K=
S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol/L,c(SO2)=5.0×10-5mol/L,c(H2O)=4.0×10-3mol/L,计算该温度下的平衡常数K=_________ ;
(5)回收H2S。用一定浓度Na2S溶液吸一定量的H2S,当溶液中c(H2S)=c(S2-)时,溶液pH=_________ (用含m、n的式子)。(已知H2S的两步电离常数Ka1=m,Ka2=n)
I.利用H2S 制CS2。
(1)热解H2S和CH4的混合气体制H2和CS2。
①2H2S(g) =2H2(g)+S2(g) ΔH1=+170kJmol-1
②CH4(g)+S2(g)=CS2(g)+2H2(g) ΔH2=+64kJmol-1
总反应:2H2S(g)+CH4(g) =CS2 (g)+4H2(g),ΔH=
(2)CH4的电子式为
(3)工业上还可以利用硫(S8) 与CH4为原料制备 CS2,S8受热分解成气态 S2, 发生反应 2S2(g)+CH4(g) =CS2(g)+2H2S(g), 某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与 CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为
②当以下数值不变时,能说明该反应达到平衡的是
a.气体密度 b. 气体总压 c.CH4 与S2体积比 d.CS2的体积分数
③一定条件下,CH4与 S2反应中 CH2的平衡转化率、S8分解产生 S2的体积分数随温度的变化由线如下图所示,据图分析,生成 CS2的反应为
(4)回收单质硫。将三分之一的H2S燃烧。产生的SO2与其余H2S混合反应:2H2S(g)+SO2(g)
(5)回收H2S。用一定浓度Na2S溶液吸一定量的H2S,当溶液中c(H2S)=c(S2-)时,溶液pH=
2024·天津和平·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网