填空题 较难0.4 引用1 组卷134
(一)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图:_______ 。
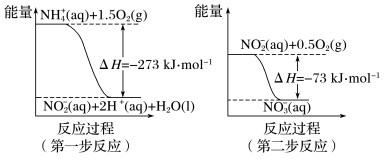
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为_______ 。
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=_____ ,C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出其反应热△H=_____ kJ•mol-1。
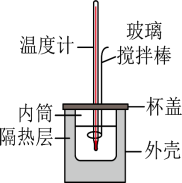
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题: 溶于不同量水中的热效度如下表:
溶于不同量水中的热效度如下表:
下列说法正确的是_______ 。
A.当 时,溶解放热
时,溶解放热
B.向 的溶液中加入9g水,放出热量6.9kJ
的溶液中加入9g水,放出热量6.9kJ
C.用 的溶液测定中和反应的反应热会使△H偏小
的溶液测定中和反应的反应热会使△H偏小
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①表中的温度差平均值为_______ ℃。
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=_____ (取小数点后一位)。
(6)下列说法正确的是_______ (填字母)。
a.为了使反应充分进行,药品可以分多次加入
b.完成一次中和反应反应热平行样的测定,温度计需要使用2次
c.测量NaOH与不同种类的酸(如HCl、 等)中和反应的反应热,数值可能不同
等)中和反应的反应热,数值可能不同
d.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
(1)有机物M经过太阳光光照可转化成N,转化过程如图:
 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
| 2.0 | 1.0 | 0.67 | 0.50 | 0.33 | ||
| 溶解放热 | 15.8 | 27.8 | 35.9 | 41.6 | 48.9 | 95.3 |
A.当
B.向
C.用
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | 2.5 |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | 4 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=
(6)下列说法正确的是
a.为了使反应充分进行,药品可以分多次加入
b.完成一次中和反应反应热平行样的测定,温度计需要使用2次
c.测量NaOH与不同种类的酸(如HCl、
d.用温度计测定NaOH溶液起始温度后直接测定
23-24高一下·湖北武汉·阶段练习
类题推荐
化学反应伴随有能量的变化,获取反应能量变化有多条途径,按要求回答下列问题:
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)用如图所示的装置进行中和反应反应热的测定。
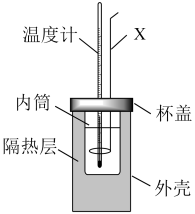
①仪器X的名称为___________ 。
②下列说法正确的是___________
A.为了使反应充分进行,药品可以分多次加入
B.完成一次中和反应反应热平行样的测定,温度计需要使用3次
C.测量NaOH与不同种类的酸中和反应的反应热,数值可能不同
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
③取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
请填写表中的空白:
近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g∙℃)。则 △H=
△H=___________ kJ/mol(保留整数)。
(3)火箭的常规燃料是液态四氧化二氮和液态肼(N2H4),N2O4作氧化剂。用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①
②
③
请写出液态肼和气态氟气反应的热化学方程式:___________ 。
(1)下列反应中,属于吸热反应的是___________(填字母)。
| A.碳与水蒸气反应 | B.铝和氧化铁反应 | C.碳酸氢钠和盐酸反应 | D.锌与盐酸反应 |

①仪器X的名称为
②下列说法正确的是
A.为了使反应充分进行,药品可以分多次加入
B.完成一次中和反应反应热平行样的测定,温度计需要使用3次
C.测量NaOH与不同种类的酸中和反应的反应热,数值可能不同
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
③取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
请填写表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t1-t2)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)火箭的常规燃料是液态四氧化二氮和液态肼(N2H4),N2O4作氧化剂。用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①
②
③
请写出液态肼和气态氟气反应的热化学方程式:
在稀溶液中,酸跟碱发生中和反应而生成 ,这时的
,这时的 叫做中和热。
叫做中和热。
(1)已知:
①

②

③

上述正确的热化学方程式中,表示中和热的热化学方程式有_______ (填序号)。
(2)常温下 溶于不同量水中的热效度如下表:
溶于不同量水中的热效度如下表:
下列说法正确的是_______ 。
A.当 时,溶解放热
时,溶解放热
B.向 的溶液中加入9g水,放出热量6.9kJ
的溶液中加入9g水,放出热量6.9kJ
C.用 的溶液测定中和热会使结果偏大
的溶液测定中和热会使结果偏大
(3)用下图所示的装置进行中和反应反应热的测定。_______
A.为了使反应充分进行,药品可以分多次加入
B.完成一次中和反应反应热平行样的测定,温度计需要使用2次
C.测量NaOH与不同种类的酸(如HCl、 等)中和反应的反应热,数值可能不同
等)中和反应的反应热,数值可能不同
D.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
②取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
请填写表中的空白:
近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容 。则中和热
。则中和热
_______ kJ/mol(保留一位小数)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.配制0.50mol/LNaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用量筒量取NaOH溶液的体积时仰视读数
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热( )会
)会_______ (填“偏大”、“偏小”“无影响”)。
(1)已知:
①
②
③
上述正确的热化学方程式中,表示中和热的热化学方程式有
(2)常温下
| 2.0 | 1.0 | 0.67 | 0.50 | 0.33 | ||
| 溶解放热 | 15.8 | 27.8 | 35.9 | 41.6 | 48.9 | 95.3 |
A.当
B.向
C.用
(3)用下图所示的装置进行中和反应反应热的测定。

A.为了使反应充分进行,药品可以分多次加入
B.完成一次中和反应反应热平行样的测定,温度计需要使用2次
C.测量NaOH与不同种类的酸(如HCl、
D.用温度计测定NaOH溶液起始温度后直接测定
②取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
请填写表中的空白:
温度 实验次数 | 起始温度 | 终止温度 | 温度差平均值 | ||
| NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.配制0.50mol/LNaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用量筒量取NaOH溶液的体积时仰视读数
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热(
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
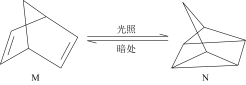 ΔH=+88.6 kJ·mol-1。
ΔH=+88.6 kJ·mol-1。