解答题-原理综合题 适中0.65 引用2 组卷83
在催化下, 加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。
加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。
Ⅰ.
Ⅱ.
回答下列问题。
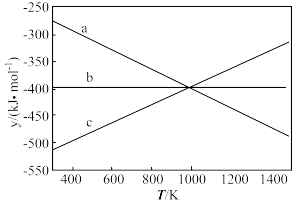
(1)已知: 时,部分物质的相对能量如表所示,则
时,部分物质的相对能量如表所示,则 的相对能量为
的相对能量为_______  。
。
(2)为了提高二氧化碳转化为甲酸的转化率,工业上常采用以下方法:

步骤1 步骤2 步骤3
①写出步骤1反应的离子方程式:_______ 。
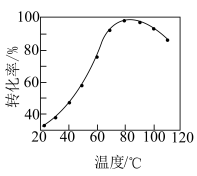
②其他条件不变,步骤1中 转化为
转化为 的转化率与温度的关系如图所示。
的转化率与温度的关系如图所示。_______ ,后又下降的可能原因是_______ 。
③流程图步骤2中,加入乙醚的作用是_______ ,步骤3的分离方法是_______ 。
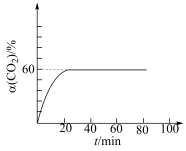
(3)保持 、恒压,
、恒压, 和
和 的投料物质的量之比为
的投料物质的量之比为 的初始分压为
的初始分压为 ,测得
,测得 的转化率
的转化率 与时间t的关系如图所示。
与时间t的关系如图所示。 ,则反应Ⅰ的
,则反应Ⅰ的
_____  (用含
(用含 的式子表示)。
的式子表示)。
Ⅰ.
Ⅱ.
回答下列问题。
(1)已知:
| 物质 | ||
| 相对能量/ |
(2)为了提高二氧化碳转化为甲酸的转化率,工业上常采用以下方法:
步骤1 步骤2 步骤3
①写出步骤1反应的离子方程式:
②其他条件不变,步骤1中
③流程图步骤2中,加入乙醚的作用是
(3)保持
2024·甘肃平凉·模拟预测
类题推荐
将CO2转化为甲烷、甲醇、甲酸等有机物是实现“碳中和”重要途径。在催化下CO2加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅰ发生。
Ⅰ.CO2(g)+H2(g) HCOOH(g) ΔH1=-30.9kJ·mol-1
HCOOH(g) ΔH1=-30.9kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
回答下列问题:
(1)已知298K时,部分物质的相对能量如下表所示,则CO2(g)的相对能量为_____ kJ·mol-1。
(2)已知气体A的压强转化率表示为α(A)=(1- )×100%,p0为A的初始分压,p1为某时刻A的分压。保持323K、恒温恒压,CO2(g)、H2(g)投料比为1:1,CO2初始分压分别为p0-aMPa、p0-bMPa和p0-cMPa(p0-a<p0-bb<P0-c)时,测得α(CO2)与时间t的关系如图1所示。
)×100%,p0为A的初始分压,p1为某时刻A的分压。保持323K、恒温恒压,CO2(g)、H2(g)投料比为1:1,CO2初始分压分别为p0-aMPa、p0-bMPa和p0-cMPa(p0-a<p0-bb<P0-c)时,测得α(CO2)与时间t的关系如图1所示。_____ (填写选项序号)。
a.p0-aMpa b.p0-bMpa c.p0-cMPa
②在323K,CO2初始分压为p0-bMPa时,平衡后,p(HCOOH)=4p(CO),则反应Ⅰ的Kp=_____ (MPa)-1(用含p0-b的式子表示)。
(3)反应CO2(g)+H2(g) CO(g)+H2O(g)的正、逆反应平衡常数K随温度变化的曲线如图2所示。
CO(g)+H2O(g)的正、逆反应平衡常数K随温度变化的曲线如图2所示。_____ (填“K正”或“K逆”)随温度变化的曲线。
②a点时,v正_____ v逆(填“一定等于”或“不一定等于”)。
③c点时,x=_____ 。
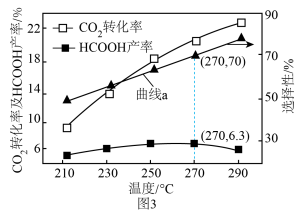
(4)0.5MPa下,将n(H2):n(CO2)=1:1的混合气体以一定流速通过装有催化剂的反应器,测得CO2的转化率、HCOOH或CO的选择性[ ]以及HCOOH的产率(CO2的转化率×HCOOH的选择性)随温度的变化如图3所示
]以及HCOOH的产率(CO2的转化率×HCOOH的选择性)随温度的变化如图3所示_____ (填“HCOOH”或“CO”)的选择性随温度的变化。270°C时,对应CO2的转化率为_____ ;在210~250°C之间,HCOOH的产率增大的原因是_____ 。
Ⅰ.CO2(g)+H2(g)
Ⅱ.CO2(g)+H2(g)
回答下列问题:
(1)已知298K时,部分物质的相对能量如下表所示,则CO2(g)的相对能量为
| 物质 | H2(g) | HCOOH(g) | H2O(g) | CO(g) |
| 相对能量/(kJ·mol-1) | 0 | -423.9 | -242 | -110 |
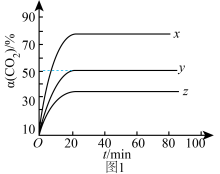
a.p0-aMpa b.p0-bMpa c.p0-cMPa
②在323K,CO2初始分压为p0-bMPa时,平衡后,p(HCOOH)=4p(CO),则反应Ⅰ的Kp=
(3)反应CO2(g)+H2(g)
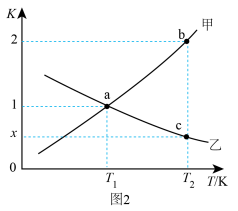
②a点时,v正
③c点时,x=
(4)0.5MPa下,将n(H2):n(CO2)=1:1的混合气体以一定流速通过装有催化剂的反应器,测得CO2的转化率、HCOOH或CO的选择性[
二氧化碳的合理转化及氮氧化物综合治理是现代化学研究的热点。回答下列问题:
(1)传统钌配合物催化作用下CO2加氢合成甲酸发生反应I,同时还伴有反应II发生。
反应Ⅰ: CO2(g)+H2(g) HCOOH(g) △H1
HCOOH(g) △H1
反应Ⅱ: CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
①已知: 298K 时,部分物质的相对能量如表所示,△H1_______ △H2(填“大于”“小于”或“等于”)。
②保持323K恒温恒压,CO2(g)、 H2(g)投料比1: 1时,CO2初始分压分别为P1MPa、P2 MPa和P3 MPa(P1<P2<P3),测得CO2的转化率α(CO2)与时间t的关系如图1所示。
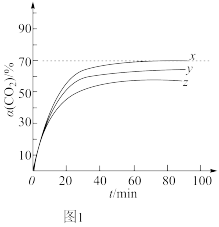
在323K, CO2初始分压为P3 MPa时,平衡后,P(HCOOH)=6P(CO), 则反应I的Kp=_______ (用含P3的式子表示)。
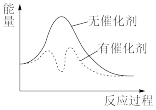
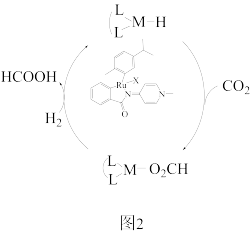
(2)一种新型钌配合物催化剂催化CO2加氢合成甲酸的反应机理如图2所示。催化剂再生的反应为_______ ,研究表明,极性溶剂有助于促进CO2插入M- H 键,使用极性溶剂后极大地提高了整个反应的合成效率的原因可能是_______ 。
(3)工业烟气中的氮氧化物可用NH3催化还原,发生反应: 4NH3(g)+6NO(g)= 5N2(g)+ 6H2O(g) ΔH<0,研究表明不同氨氮比[m= ]条件下测得NO的残留率与温度关系如图3所示。
]条件下测得NO的残留率与温度关系如图3所示。
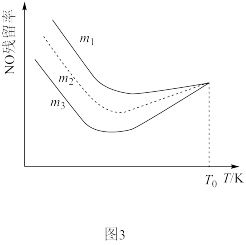
①m1、m2、m3的大小关系_______ 。
②随着温度不断升高,NO的残留率趋近相同的可能原因是_______ 。
(4)利用Au/Ag3PO4光催化去除氮氧化物(O2将氮氧化物氧化为 ;),研究表明,不同Au的负载量与氮氧化物的去除效果、催化去除速率常数(用k表示,其他条件不变时,速率常数越大,速率越大)大小的关系分别如图4、图5表示。已知:催化剂的活性与其表面的单位面积活性位点数有关。
;),研究表明,不同Au的负载量与氮氧化物的去除效果、催化去除速率常数(用k表示,其他条件不变时,速率常数越大,速率越大)大小的关系分别如图4、图5表示。已知:催化剂的活性与其表面的单位面积活性位点数有关。

①综合图4、图5可知催化效果最佳的是_______ (填催化剂)。
②图5表面随着Au的负载量不断增加,反应速率常数先增大后减小,试分析反应速率常数减小的原因是_______ 。
(1)传统钌配合物催化作用下CO2加氢合成甲酸发生反应I,同时还伴有反应II发生。
反应Ⅰ: CO2(g)+H2(g)
反应Ⅱ: CO2(g)+H2(g)
①已知: 298K 时,部分物质的相对能量如表所示,△H1
| 物质 | CO2(g) | H2(g) | H2O(g) | CO(g) | HCOOH(g) |
| 相对能量/(kJ·mol-1) | -393 | 0 | -242 | -110 | -423.9 |
②保持323K恒温恒压,CO2(g)、 H2(g)投料比1: 1时,CO2初始分压分别为P1MPa、P2 MPa和P3 MPa(P1<P2<P3),测得CO2的转化率α(CO2)与时间t的关系如图1所示。

在323K, CO2初始分压为P3 MPa时,平衡后,P(HCOOH)=6P(CO), 则反应I的Kp=
(2)一种新型钌配合物催化剂催化CO2加氢合成甲酸的反应机理如图2所示。催化剂再生的反应为

(3)工业烟气中的氮氧化物可用NH3催化还原,发生反应: 4NH3(g)+6NO(g)= 5N2(g)+ 6H2O(g) ΔH<0,研究表明不同氨氮比[m=

①m1、m2、m3的大小关系
②随着温度不断升高,NO的残留率趋近相同的可能原因是
(4)利用Au/Ag3PO4光催化去除氮氧化物(O2将氮氧化物氧化为

①综合图4、图5可知催化效果最佳的是
②图5表面随着Au的负载量不断增加,反应速率常数先增大后减小,试分析反应速率常数减小的原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网