解答题-实验探究题 适中0.65 引用2 组卷139
某小组探究 在盐酸中分别与铜单质和铜离子的反应,从改变氧化产物、还原产物浓度的角度分析物质氧化性和还原性的变化规律。
在盐酸中分别与铜单质和铜离子的反应,从改变氧化产物、还原产物浓度的角度分析物质氧化性和还原性的变化规律。
I.探究 在盐酸中与
在盐酸中与 的反应
的反应
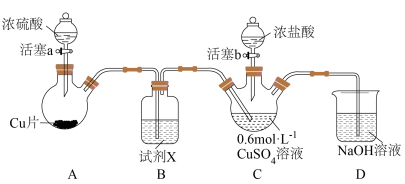
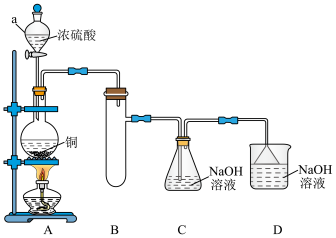
用如下装置(夹持、加热仪器略)制备 ,将
,将 通入
通入 溶液。通
溶液。通 一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入
一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入 ,C中溶液变棕黄色。
,C中溶液变棕黄色。___________ ,为除去 中含有的少量硫酸酸雾,并观察气流速率,B中盛放试剂X是
中含有的少量硫酸酸雾,并观察气流速率,B中盛放试剂X是___________ 。装置C中盛放浓盐酸的仪器名称为___________ 。
(2)资料:CuCl难溶于水,在浓盐酸溶液中存在平衡:CuCl(白色) 。补充实验证实棕黄色溶液中含
。补充实验证实棕黄色溶液中含 ,实验方案为
,实验方案为___________ 。
(3)一个氧化还原反应包括氧化反应和还原反应两个过程(即两个半反应), 与
与 溶液反应生成
溶液反应生成 和
和 的过程可分为下面两个半反应:
的过程可分为下面两个半反应:
氧化反应:___________ ;还原反应: 。
。
根据还原反应式,分析加入浓盐酸前后实验现象有差异的可能原因___________ 。
(4)综上分析, 在盐酸中与
在盐酸中与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
实验结论:综合上述实验可知,还原反应中,降低生成物浓度,氧化剂的氧化性增强。
II.探究 在盐酸中与Cu单质的反应
在盐酸中与Cu单质的反应
将装置C中 溶液替换成Cu片和
溶液替换成Cu片和 溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。
溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。
(5)经检验黑色固体是 ,
, 在盐酸中与Cu单质反应的离子方程式为
在盐酸中与Cu单质反应的离子方程式为___________ 。
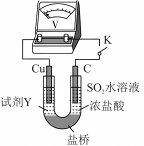
(6)为了进一步探究影响铜单质还原性的因素,进行了如下实验:
实验ii中,Cu片附近溶液变棕黄色。a是___________ ,b是___________ 。
综合上述实验可知:氧化反应中,降低生成物浓度,还原剂的还原性增强。
I.探究
用如下装置(夹持、加热仪器略)制备
(2)资料:CuCl难溶于水,在浓盐酸溶液中存在平衡:CuCl(白色)
(3)一个氧化还原反应包括氧化反应和还原反应两个过程(即两个半反应),
氧化反应:
根据还原反应式,分析加入浓盐酸前后实验现象有差异的可能原因
(4)综上分析,
实验结论:综合上述实验可知,还原反应中,降低生成物浓度,氧化剂的氧化性增强。
II.探究
将装置C中
(5)经检验黑色固体是
(6)为了进一步探究影响铜单质还原性的因素,进行了如下实验:
| 序号 | 实验装置图 | 试剂Y | 电压表 |
| i |
| 指针几乎不偏转 | |
| ii | a | 指针明显偏转 | |
| iii | a+b | 指针偏转幅度更大 |
综合上述实验可知:氧化反应中,降低生成物浓度,还原剂的还原性增强。
23-24高三下·天津·阶段练习
类题推荐
实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是____ 。
(2)写出C中制备NaHSO3的离子方程式____ 。
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
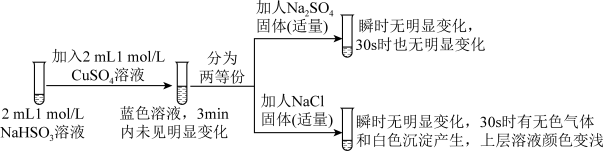
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO 的还原性
的还原性
b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_____ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
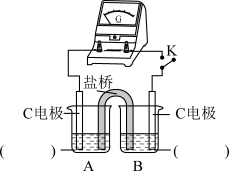
ⅰ.补全电化学装置示意图____ 。
ⅱ.写出B中的电极反应方程式____ 。
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,____ ,使HSO 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+ HAuCl4
HAuCl4
(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:____ 。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO
b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 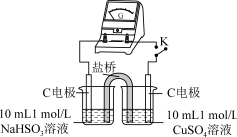 | 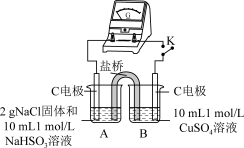 |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
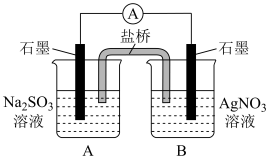
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

ⅰ.补全电化学装置示意图
ⅱ.写出B中的电极反应方程式
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+
(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:
资料显示, 能还原
能还原 、
、 ,某小组对此进行探究。
,某小组对此进行探究。
实验:将 溶液滴入到物质a中,记录如下:
溶液滴入到物质a中,记录如下:
(1)用化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因___________ 。
(2)经检验,I中白色沉淀是 。用酸性
。用酸性 溶液证实白色沉淀中含有
溶液证实白色沉淀中含有 ,现象是
,现象是___________ 。
(3)重新设计实验(III),证实了: 能还原
能还原 ,装置如下图所示。
,装置如下图所示。
现象:i.电流表指针偏转。
ii.B中石墨电极上析出白色固体。
取出少量白色固体,洗涤后,___________ (填操作和现象),证明白色固体中含有Ag。
(4)经检验,II中的棕黄色沉淀不含 ,含有
,含有 、
、 和
和 。
。
资料: ,
, 。
。
①用稀 溶解沉淀,析出红色固体,说明棕黄色沉淀中含有
溶解沉淀,析出红色固体,说明棕黄色沉淀中含有___________ 。
②通过下列实验证实,沉淀中含有 和上层清液中仍检出了
和上层清液中仍检出了 (忽略空气的影响)。
(忽略空气的影响)。
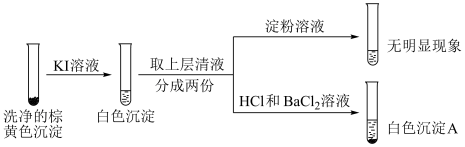
i.白色沉淀A是 。
。
ii.根据资料,上层清液加入淀粉后应该变蓝。分析现象与资料不符的原因:
原因一:KI未被氧化。则将 氧化的微粒是
氧化的微粒是___________ 。
原因二:KI被氧化,由于___________ (用离子方程式表示),所以无明显现象。
③当加入的KI过量且反应充分时,白色沉淀中不含Cu单质,上层清液中仍检出了 。结合物质组成、化学反应等解释上层清液中检出
。结合物质组成、化学反应等解释上层清液中检出 的原因
的原因___________ 。
小结:I中: 未能还原
未能还原 的原因与反应速率、离子浓度变化等因素有关。
的原因与反应速率、离子浓度变化等因素有关。
实验:将
| 序号 | 装置 | 物质a | 现象 |
| I |  2 mL 物质a | 饱和 | 产生白色沉淀 |
| II | 0.2 mol/L | 溶液变绿,继续滴加产生棕黄色沉淀 |
(1)用化学用语解释
(2)经检验,I中白色沉淀是
(3)重新设计实验(III),证实了:

现象:i.电流表指针偏转。
ii.B中石墨电极上析出白色固体。
取出少量白色固体,洗涤后,
(4)经检验,II中的棕黄色沉淀不含
资料:
①用稀
②通过下列实验证实,沉淀中含有

i.白色沉淀A是
ii.根据资料,上层清液加入淀粉后应该变蓝。分析现象与资料不符的原因:
原因一:KI未被氧化。则将
原因二:KI被氧化,由于
③当加入的KI过量且反应充分时,白色沉淀中不含Cu单质,上层清液中仍检出了
小结:I中:
实验室探究NaHSO3溶液与Cu2+的反应。如图所示制备(经检验装置气密性良好)。___________ 。
(2)装置B的作用___________ 。
(3)写出C中制备NaHSO3的离子方程式___________ 。
(4)探究NaHSO3溶液与Cu2+的反应,过程如图所示:
ii.硫酸亚铜易溶于水。
加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。探究加入NaCl固体发生反应的原因:
假设:a.Cl-改变了 的还原性 b.Cl-改变了Cu2+的氧化性
的还原性 b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是___________ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
A:10mL1mol/LNaHSO3溶液、B:___________ 。
ii.写出B溶液中电极区域发生的反应方程式___________ 。
iii.请你结合Cu2+与 的离子反应方程式,从反应平衡移动的角度,解释加加入NaCl能促进Cu2+与
的离子反应方程式,从反应平衡移动的角度,解释加加入NaCl能促进Cu2+与 反应进行的原因:
反应进行的原因:___________ 。
(2)装置B的作用
(3)写出C中制备NaHSO3的离子方程式
(4)探究NaHSO3溶液与Cu2+的反应,过程如图所示:

ii.硫酸亚铜易溶于水。
加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。探究加入NaCl固体发生反应的原因:
假设:a.Cl-改变了
用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 |
|
|
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

A:10mL1mol/LNaHSO3溶液、B:
ii.写出B溶液中电极区域发生的反应方程式
iii.请你结合Cu2+与
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网