解答题-原理综合题 较难0.4 引用1 组卷35
Ⅰ.利用
(1)写出该制备方法的离子方程式
(2)
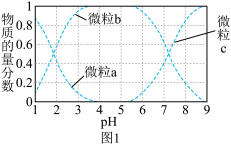
| A.曲线 |
| B. |
| C. |
| D. |
Ⅱ.利用工业废碱渣(主要成分
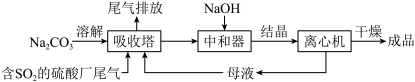
(4)图2为吸收塔中
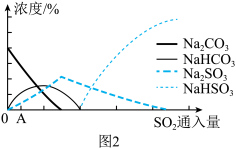
| 资料显示: Ⅰ. Ⅱ.无水 |
(6)为了降低由中和器所得溶液中
①请结合化学反应原理解释
②结晶时应选择的最佳操作是
a.
b.维持
c.
(7)为检验
23-24高二上·北京·期末
类题推荐
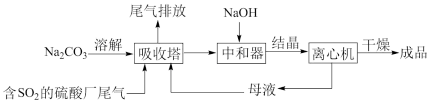
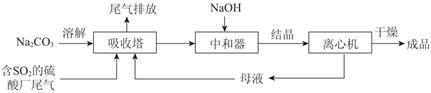
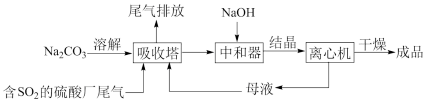
Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
(1)举例说明向大气中排放SO2导致的环境问题:_________ 。
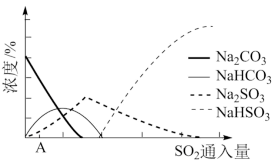
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________ 。

(3)中和器中发生的主要反应的化学方程式是_________ 。
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________ 。
②结晶时应选择的最佳操作是_________ (选填字母)。
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________ 、_________ 。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是:____ IO3-+____ SO32- =___________ +___________ (将方程式补充完整)
②成品中Na2SO3(M =126 g/mol)的质量分数是_________ 。

(1)举例说明向大气中排放SO2导致的环境问题:
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是

(3)中和器中发生的主要反应的化学方程式是
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因
②结晶时应选择的最佳操作是
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是:
②成品中Na2SO3(M =126 g/mol)的质量分数是
Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2,同时制备无水Na2SO3的方法工艺简便、成本低廉,优势明显。其流程如下:_______ 。
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_______ 。
(3)中和器中发生的主要反应的化学方程式是_______ 。
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_______ 。
②结晶时应选择的最佳操作是_______ (填字母)。
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
(5)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260 g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定,到达终点时,消耗KIO3标准溶液体积为y mL。(已知 ;还原性:
;还原性: )
)
①滴定终点前反应的离子方程式是:_______ (将方程式补充完整)

②滴定终点的现象为_______ 。
③成品中Na2SO3 (M=126 g/mol)的质量分数是_______ 。

(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是
(3)中和器中发生的主要反应的化学方程式是
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
①请结合Na2SO3的溶解平衡解释NaOH过量的原因
②结晶时应选择的最佳操作是
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
(5)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260 g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定,到达终点时,消耗KIO3标准溶液体积为y mL。(已知
①滴定终点前反应的离子方程式是:
②滴定终点的现象为
③成品中Na2SO3 (M=126 g/mol)的质量分数是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网