解答题-原理综合题 适中0.65 引用1 组卷24
Ⅰ、化学实验中,通常需要使用到硫酸
(1)向Na2S2O3溶液滴加稀硫酸,产生淡黄色沉淀,写出反应的离子方程式___________ 。
(2)向硫酸酸化的KMnO4溶液中滴加草酸溶液,紫红色褪去。写出反应的离子方程式___________ 。
Ⅱ、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=
④CH3OH(1)=CO(g)+2H2(g) △H4=
(3)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式___________ 。反应②需要在___________ (高温、低温)下才能自发进行
(4)几种化学键的键能如下表所示:
根据以上有关反应的△H,计算x=___________ 。
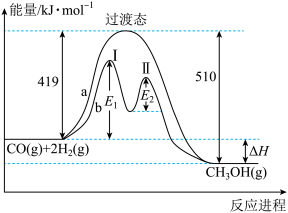
(5)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:
方式Ⅱ:
活化能E值推测,甲醇脱氢过程中主要历程的方式为___________ (填"Ⅰ"或"Ⅱ")。计算机模拟的各步反应的能量变化示意图如下。___________ 。
(1)向Na2S2O3溶液滴加稀硫酸,产生淡黄色沉淀,写出反应的离子方程式
(2)向硫酸酸化的KMnO4溶液中滴加草酸溶液,紫红色褪去。写出反应的离子方程式
Ⅱ、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=
④CH3OH(1)=CO(g)+2H2(g) △H4=
(3)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式
(4)几种化学键的键能如下表所示:
| 化学键 | C=O | H—H | C—H | O—H | |
| 键能/kJ·mol-1 | 803 | 436 | x | 414 | 463 |
(5)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:
方式Ⅱ:
活化能E值推测,甲醇脱氢过程中主要历程的方式为
23-24高三上·黑龙江绥化·期末
类题推荐
甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下,则该反应的ΔH=_______ kJ·mol-1。
(2)上述反应中所需的甲醇,工业上利用水煤气合成:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:
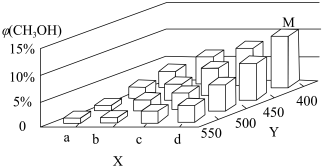
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_______ 。
②X轴上a点的数值比b点_______ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_______ 。
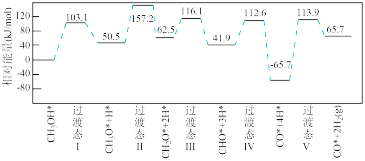
(3)工业上可采用CH3OH CO+2H2来制取高纯度的CO和H2.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯基催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能的方式:
CO+2H2来制取高纯度的CO和H2.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯基催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能的方式:
方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH +OH* Eb=+249.3 kJ·mol-1
+OH* Eb=+249.3 kJ·mol-1
实验证实甲醇裂解过程主要历经的方式为A,试推测可能的原因_______ 。
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为_______ 。
(4)PbI2与金属锂以LiIAl2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为2Li+PbI2=2LiI+Pb,则b极上的电极反应式为_______ 。

(5)CH3NH2的电离方程式为CH3NH2+H2O⇌CH3NH +OH-,电离常数为Kb,已知常温下pKb=-lg Kb=3.4,则常温下向CH3NH2溶液中滴加稀硫酸至c(CH3NH2)=c(CH3NH
+OH-,电离常数为Kb,已知常温下pKb=-lg Kb=3.4,则常温下向CH3NH2溶液中滴加稀硫酸至c(CH3NH2)=c(CH3NH )时,溶液pH=
)时,溶液pH=_______ 。
(6)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_______ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下,则该反应的ΔH=
| 共价键 | C—O | H—O | N—H | C—N | C—H |
| 键能/(kJ·mol-1) | 351 | 463 | 393 | 293 | 414 |
(2)上述反应中所需的甲醇,工业上利用水煤气合成:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
(3)工业上可采用CH3OH
方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH
实验证实甲醇裂解过程主要历经的方式为A,试推测可能的原因
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为
(4)PbI2与金属锂以LiIAl2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为2Li+PbI2=2LiI+Pb,则b极上的电极反应式为

(5)CH3NH2的电离方程式为CH3NH2+H2O⇌CH3NH
(6)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=
工业上可采用CH3OH⇌CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1(其中Ea、Eb为活化能)。
图为计算机模拟的各步反应的能量变化示意图。
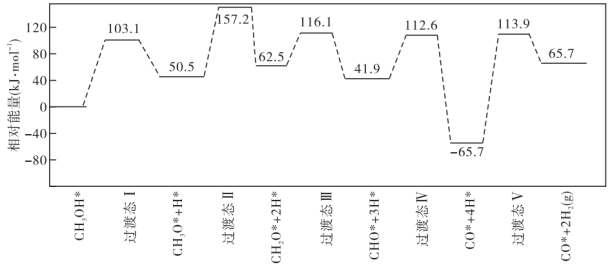
下列说法错误的是
方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1(其中Ea、Eb为活化能)。
图为计算机模拟的各步反应的能量变化示意图。

下列说法错误的是
| A.总反应的焓变(△H)大于0 |
| B.甲醇裂解过程主要历经的方式应为B |
| C.该历程中最小能垒(活化能)为53.6 kJ·mol-1 |
| D.该历程中,放热最多的步骤的化学方程式为CHO*+3H*=CO*+4H* |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网