解答题-无机推断题 适中0.65 引用1 组卷30
(I)元素是组成我们生活的世界中一切物质的“原材料”。
(1)1869年,门捷列夫在前人研究的基础上研制出了第一张元素周期表。到20世纪初,门捷列夫在周期表中为未知元素留下的空位逐渐被填满,而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量的递增呈现周期性变化,而是随着原子序数(核电荷数)的递增呈现周期性变化。其本质原因是___________ (填字母序号)。
A.随着核电荷数递增,原子半径呈现周期性变化
B.随着核电荷数递增,元素的化合价呈现周期性变化
C.随着核电荷数递增,原子核外电子排布呈现周期性变化
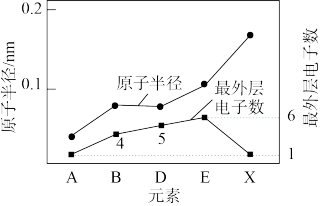
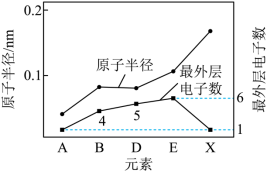
(2)有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物对应的水化物与强酸、强碱均能反应。Z的单质常温下为气态,同条件下对于氢气的相对密度为35.5.其余元素的信息如图所示:___________ 。
②A、D、Z三种元素所形成的化合物DA4Z中的化学键类型是___________ 。
③X的最高价氧化物对应水化物与Y的单质反应的离子方程式为___________ 。
④下列可以判断X和Y元素原子失电子能力强弱的是___________ (填字母序号)。
a.单质的熔点X比Y低
b.单质与酸反应时,失电子数X比Y少
c.单质与水反应X比Y剧烈
d.最高价氧化物的水化物的碱性X比Y强
(3)已知天然气的主要成分甲烷(CH4)燃烧时的能量变化如图所示:___________ kJ。
(1)1869年,门捷列夫在前人研究的基础上研制出了第一张元素周期表。到20世纪初,门捷列夫在周期表中为未知元素留下的空位逐渐被填满,而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量的递增呈现周期性变化,而是随着原子序数(核电荷数)的递增呈现周期性变化。其本质原因是
A.随着核电荷数递增,原子半径呈现周期性变化
B.随着核电荷数递增,元素的化合价呈现周期性变化
C.随着核电荷数递增,原子核外电子排布呈现周期性变化
(2)有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物对应的水化物与强酸、强碱均能反应。Z的单质常温下为气态,同条件下对于氢气的相对密度为35.5.其余元素的信息如图所示:
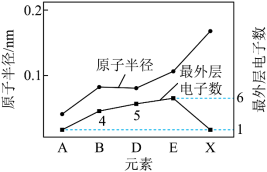
②A、D、Z三种元素所形成的化合物DA4Z中的化学键类型是
③X的最高价氧化物对应水化物与Y的单质反应的离子方程式为
④下列可以判断X和Y元素原子失电子能力强弱的是
a.单质的熔点X比Y低
b.单质与酸反应时,失电子数X比Y少
c.单质与水反应X比Y剧烈
d.最高价氧化物的水化物的碱性X比Y强
(3)已知天然气的主要成分甲烷(CH4)燃烧时的能量变化如图所示:
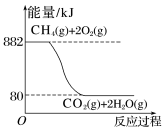
23-24高一下·山东泰安·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网