解答题-原理综合题 适中0.65 引用2 组卷742
金属有机配合物广泛应用于各类催化反应。
Ⅰ.某铁的配合物催化1-丁烯和 加成的部分历程如图。
加成的部分历程如图。 加成的化学方程式
加成的化学方程式___________ 。
②若丙→乙的活化能为 ,则甲→丙的反应热△H=
,则甲→丙的反应热△H=___________  (用含a的式子表达)。
(用含a的式子表达)。
(2)甲、乙的结构如图所示,Ar表示苯基。___________ 。
②下列说法正确的是___________ (填标号)。
A.甲→乙的过程中有 键的断裂和形成
键的断裂和形成
B.乙→丙的速率比甲→乙慢
C.升高温度,乙的平衡浓度减小
D.选用合适的催化剂可提高1-丁烯的平衡转化率
Ⅱ.某金属配合物的合成反应为: 。该金属配合物的吸光度A随
。该金属配合物的吸光度A随 的变化如图所示[
的变化如图所示[ 为定值]。
为定值]。 为M和R完全反应的吸光度,
为M和R完全反应的吸光度, 为实际测得的最大吸光度,吸光度和
为实际测得的最大吸光度,吸光度和 的浓度成正比。
的浓度成正比。___________ 。
(4)解离平衡 的解离度
的解离度 (即
(即 的平衡转化率)为
的平衡转化率)为___________ (用含 、
、 的式子表示)。
的式子表示)。
(5)若x=1,将10mL 0.01
 、5mL 0.001
、5mL 0.001 M溶液、5mL 0.001
M溶液、5mL 0.001 R溶液混合,测得解离度
R溶液混合,测得解离度 ,计算
,计算 的解离平衡常数
的解离平衡常数 (写出计算过程)。
(写出计算过程)。___________
Ⅰ.某铁的配合物催化1-丁烯和
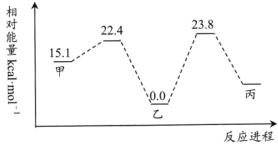
②若丙→乙的活化能为
(2)甲、乙的结构如图所示,Ar表示苯基。
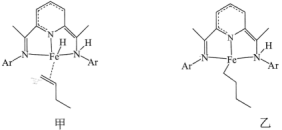
②下列说法正确的是
A.甲→乙的过程中有
B.乙→丙的速率比甲→乙慢
C.升高温度,乙的平衡浓度减小
D.选用合适的催化剂可提高1-丁烯的平衡转化率
Ⅱ.某金属配合物的合成反应为:
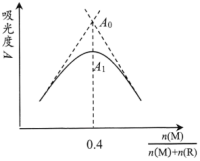
(4)解离平衡
(5)若x=1,将10mL 0.01
2024·广东佛山·二模
类题推荐  与
与 在固载金属催化剂(M)上可发生以下反应:
在固载金属催化剂(M)上可发生以下反应:
反应ⅰ:

反应ⅱ:

反应ⅲ:……
可能的机理如图所示:

(1)写出反应ⅲ的化学方程式:___________ 。
(2)已知298K时下列几种物质的标准生成焓。
[在标态和T(K)条件下由指定单质生成1mol某种物质的焓变]
则反应ⅱ的
___________ 。
(3)向一装有催化剂的反应容器中通入 和
和 ,维持体系压强为p MPa,只发生反应ⅰ和ⅱ,测得不同投料比下
,维持体系压强为p MPa,只发生反应ⅰ和ⅱ,测得不同投料比下 的平衡转化率随温度变化的曲线如图甲所示;
的平衡转化率随温度变化的曲线如图甲所示; 时,HCHO和HCOOH的选择性随温度的变化曲线如图乙所示。
时,HCHO和HCOOH的选择性随温度的变化曲线如图乙所示。
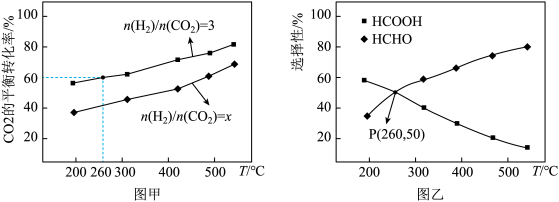
已知:物质B的选择性
①图甲中x___________ (填“>”、“<”或“=”)3,理由是___________ 。
②下列说法正确的是___________ (填标号)。
A.当容器中气体密度不再变化时,体系处于平衡状态
B.体系达平衡时,若分离出部分 ,反应ⅱ的平衡常数值将增大
,反应ⅱ的平衡常数值将增大
C.若充入稀有气体,体系重新达平衡时HCHO的物质的量会减少
D.升高温度,反应ⅰ的 增大,
增大, 减小
减小
③P点对应的体系中消耗了2.7mol ,则体系中充入的
,则体系中充入的
___________ mol,此时反应ⅰ的平衡常数
___________ 。(列出计算式即可) 为以分+压表示的平衡常数,分压=总压×物质的量分数)。
为以分+压表示的平衡常数,分压=总压×物质的量分数)。
反应ⅰ:
反应ⅱ:
反应ⅲ:……
可能的机理如图所示:

(1)写出反应ⅲ的化学方程式:
(2)已知298K时下列几种物质的标准生成焓。
[在标态和T(K)条件下由指定单质生成1mol某种物质的焓变]
| 物质 | HCHO(g) | |||
| 标准生成焓/ | -393.5 | -242 | -115.9 | 0 |
(3)向一装有催化剂的反应容器中通入

已知:物质B的选择性
①图甲中x
②下列说法正确的是
A.当容器中气体密度不再变化时,体系处于平衡状态
B.体系达平衡时,若分离出部分
C.若充入稀有气体,体系重新达平衡时HCHO的物质的量会减少
D.升高温度,反应ⅰ的
③P点对应的体系中消耗了2.7mol
二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。
(1)CO2可用于制取纯碱。纯碱溶液呈碱性的原因是___________ (用离子方程式表示),溶液中离子浓度由大到小的顺序为___________ 。
(2)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:

反应ⅱ:

①CO(g)和H2(g)合成甲醇的热化学方程式为___________ ;该反应达平衡后,若升高温度,平衡___________ 移动。
A.正向 B.逆向
②甲醇燃料电池工作原理如下图,下列有关叙述正确的是___________ 。
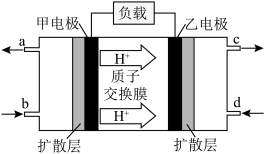
A.a导出的气体是O2
B.电池工作时,电子由甲电极经外电路流向乙电极
C.乙电极的反应式为
D.当外电路通过0.6 mol电子时,理论上消耗甲醇1.6 g
(3)将1 mol CO2和3 mol H2充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。
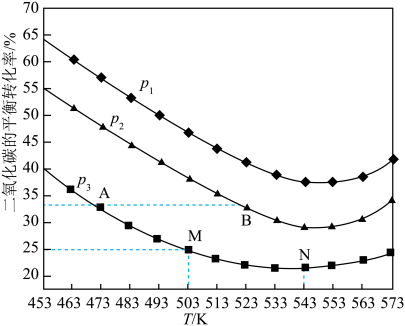
①压强p1、p2、p3由小到大的顺序为___________ 。
②A点、M点的化学反应速率大小:
___________  。
。
A.小于 B.等于 C.大于
③温度高于543 K时,CO2平衡转化率随温度的升高而增大的原因是___________ 。
④图中M点对应的温度下,平衡体系中CH3OH的物质的量为0.15 mol,则CO的选择性为___________ 。(CO的选择性 )。
)。
(4)CO2可合成有机试剂DMF,用含金属铱(Ir)的化合物催化,反应机理如下图(其中L表示配体)。下列说法正确的是___________。

(5)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率, 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率, (
( )。实验测得
)。实验测得 时,
时, 乙酸的
乙酸的 。该条件下测定的乙酸的电离度为
。该条件下测定的乙酸的电离度为___________ %;乙酸的电离平衡常数 为
为___________ (计算结果保留2位有效数字)。
(1)CO2可用于制取纯碱。纯碱溶液呈碱性的原因是
(2)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:
反应ⅱ:
①CO(g)和H2(g)合成甲醇的热化学方程式为
A.正向 B.逆向
②甲醇燃料电池工作原理如下图,下列有关叙述正确的是

A.a导出的气体是O2
B.电池工作时,电子由甲电极经外电路流向乙电极
C.乙电极的反应式为
D.当外电路通过0.6 mol电子时,理论上消耗甲醇1.6 g
(3)将1 mol CO2和3 mol H2充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。

①压强p1、p2、p3由小到大的顺序为
②A点、M点的化学反应速率大小:
A.小于 B.等于 C.大于
③温度高于543 K时,CO2平衡转化率随温度的升高而增大的原因是
④图中M点对应的温度下,平衡体系中CH3OH的物质的量为0.15 mol,则CO的选择性为
(4)CO2可合成有机试剂DMF,用含金属铱(Ir)的化合物催化,反应机理如下图(其中L表示配体)。下列说法正确的是___________。

| A.CO2在反应中断裂极性键 |
B.总反应方程式为H2+ +CO2 +CO2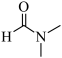 +H2O +H2O |
| C.配合物C中的配位键由Ir提供孤电子对 |
| D.最后一步生成DMF的反应类型为氧化反应 |
(5)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



