解答题-实验探究题 适中0.65 引用1 组卷182
氯亚铂酸钾( )是制备奥铂等抗肿瘤药物的重要中间体。某科研小组以氯铂酸钾(
)是制备奥铂等抗肿瘤药物的重要中间体。某科研小组以氯铂酸钾( )为原料制备
)为原料制备 ,相关物质性质如下表:
,相关物质性质如下表:
Ⅰ. 的制备
的制备
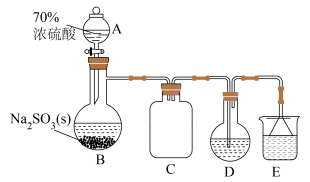
取10.00g氯铂酸钾( )溶于热水,置于装置D中,按下图所示组装实验仪器(加热与夹持装置均已省略),在加热条件下还原
)溶于热水,置于装置D中,按下图所示组装实验仪器(加热与夹持装置均已省略),在加热条件下还原 可得
可得 。
。 ,其物质的量浓度为
,其物质的量浓度为_____  。
。
(2)为使仪器A中的浓硫酸顺利滴下,需进行的操作为_____ 。
(3)仪器B的名称为_____ ,装置C的作用是_____ 。
(4)装置D中反应的化学方程式为_____ ,装置E中的试剂可选用_____ (填序号)。
A.氨水 B.NaOH溶液 C.澄清石灰水
(5)反应结束后,拆除装置,向装置D中加入足量无水乙醇,经过滤、洗涤、干燥,得红色固体6.25g。
①加入无水乙醇的目的是_____ 。
② 的产率为
的产率为_____ (结果保留三位有效数字)。_____ 。
(7)奥铂中H-N-H的键角大于1,2-环已二胺中H-N-H的键角,原因是_____ 。
(8)1,2-环己二胺的沸点(190℃)高于1,2-环戊二胺(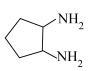 )的沸点(170℃),其主要原因是
)的沸点(170℃),其主要原因是_____ 。
| 物质 | 性质 |
| 黄色粉末,溶于热水,微溶于冷水,几乎不溶于乙醇 | |
| 红色固体,溶于水,不溶于乙醇,高温易分解 |
取10.00g氯铂酸钾(
(2)为使仪器A中的浓硫酸顺利滴下,需进行的操作为
(3)仪器B的名称为
(4)装置D中反应的化学方程式为
A.氨水 B.NaOH溶液 C.澄清石灰水
(5)反应结束后,拆除装置,向装置D中加入足量无水乙醇,经过滤、洗涤、干燥,得红色固体6.25g。
①加入无水乙醇的目的是
②
Ⅱ.奥铂(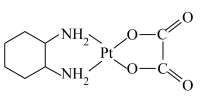 )是一种稳定的水溶性广谱抗肿瘤试剂,1,2-环己二胺(
)是一种稳定的水溶性广谱抗肿瘤试剂,1,2-环己二胺( )是制备奥铂的原料之一。
)是制备奥铂的原料之一。
(7)奥铂中H-N-H的键角大于1,2-环已二胺中H-N-H的键角,原因是
(8)1,2-环己二胺的沸点(190℃)高于1,2-环戊二胺(
 )的沸点(170℃),其主要原因是
)的沸点(170℃),其主要原因是2024·福建漳州·三模
类题推荐
联苄( )是一种重要的有机合成中间体,实验室可用苯和1,
)是一种重要的有机合成中间体,实验室可用苯和1, 二氯乙烷为原料,在无水AlCl3催化下加热制得。查阅资料:
二氯乙烷为原料,在无水AlCl3催化下加热制得。查阅资料:
Ⅰ.催化剂(AlCl3)的制备:图中是实验室制取并收集少量无水AlCl3的相关实验装置的仪器和药品。

(1)制备无水AlCl3的导管接口顺序为d→___________ (填序号,不重复使用)。
(2)装置B中制氯气的化学方程式为___________ 。
(3)在选择收集装置时,常选用图中F,而不选择以下所给图的原因是___________ 。

Ⅱ.苄的制备:联苄的制取原理为: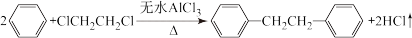 ,实验装置如图所示
,实验装置如图所示 加热和加持仪器略去
加热和加持仪器略去 :
:

实验步骤:
在三口烧瓶中加入120.0ml苯和适量无水AlCl3,由滴液漏斗滴加 二氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、
二氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、 溶液和H2O洗涤分离,在所得产物中加入少量无水
溶液和H2O洗涤分离,在所得产物中加入少量无水 固体,静止、过滤,先常压蒸馏,再减压蒸馏收集
固体,静止、过滤,先常压蒸馏,再减压蒸馏收集 的馏分,得联苄
的馏分,得联苄 。
。
(4)依次用稀盐酸、碳酸钠溶液、水洗涤后均需要进行的操作是___________ 。
(5)洗涤操作中,水洗涤的主要目的是___________ 。
(6)常压蒸馏时,除去的杂质为___________ 。
(7)该实验的产率约为___________  计算结果保留3位有效数字
计算结果保留3位有效数字 。
。
 )是一种重要的有机合成中间体,实验室可用苯和1,
)是一种重要的有机合成中间体,实验室可用苯和1,| 名称 | 相对分子质量 | 密度/(g/mL) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.9 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2-二氯乙烷 | 99 | 1.3 | -35.5 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.4 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 1.0 | 52 | 284 | 难溶水,易溶苯 |

(1)制备无水AlCl3的导管接口顺序为d→
(2)装置B中制氯气的化学方程式为
(3)在选择收集装置时,常选用图中F,而不选择以下所给图的原因是

Ⅱ.苄的制备:联苄的制取原理为:
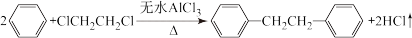 ,实验装置如图所示
,实验装置如图所示
实验步骤:
在三口烧瓶中加入120.0ml苯和适量无水AlCl3,由滴液漏斗滴加
(4)依次用稀盐酸、碳酸钠溶液、水洗涤后均需要进行的操作是
(5)洗涤操作中,水洗涤的主要目的是
(6)常压蒸馏时,除去的杂质为
(7)该实验的产率约为
溴乙烷( )是有机合成的重要原料。制备溴乙烷通常是用溴化钠与一定浓度的硫酸和乙醇反应。某实验小组的同学准备在实验室用如图所示装置制取溴乙烷(夹持、加热及尾气处理装置已略去)。
)是有机合成的重要原料。制备溴乙烷通常是用溴化钠与一定浓度的硫酸和乙醇反应。某实验小组的同学准备在实验室用如图所示装置制取溴乙烷(夹持、加热及尾气处理装置已略去)。

已知:① ;
;
②溴乙烷和乙醇的部分性质如下表:
实验操作步骤如下:
①检查装置的气密性;
②在烧瓶中加入19mL浓硫酸(0.35mol)、10mL乙醇(0.17mol)及9mL水,冷却至室温,再加入溴化钠15.5g(0.15mol)和几粒碎瓷片;
③小心加热,使其充分反应;
④再经过一系列操作制得纯净的溴乙烷。
试回答下列问题:
(1)图中仪器B的名称为____ ;A为上口加有塞子的冰水浴回流装置,其作用为_____ 。
(2)步骤②中在烧瓶中加入乙醇、浓硫酸及水,三种试剂加入的顺序是_______ (填标号)。
A.先加浓硫酸再加乙醇与水 B.先加乙醇与水,再加浓硫酸 C.三者不分先后
(3)若温度过高,反应中有红棕色气体( )产生,该反应的化学方程式为
)产生,该反应的化学方程式为_______ ,反应结束后,得到粗产品呈棕黄色,为除去其中的杂质,可选试剂是_______ (填标号)。
A.乙醇 B.四氯化碳 C. 溶液
溶液
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水 ,然后进行的实验操作是
,然后进行的实验操作是_______ (填标号)。
A.分液 B.蒸馏 C.萃取
(5)水槽中采用冰水浴的原因是_______ 。
(6)最后收集到溴乙烷10.0g,则该实验中澳乙烷的产率为_______ (保留小数点后1位, )。
)。

已知:①
②溴乙烷和乙醇的部分性质如下表:
| 沸点/℃ | 水中的溶解性 | 密度/( | 相对分子质量 | |
| 乙醇 | 78 | 混溶 | 0.8 | 46 |
| 溴乙烷 | 38.4 | 难溶 | 1.46 | 109 |
①检查装置的气密性;
②在烧瓶中加入19mL浓硫酸(0.35mol)、10mL乙醇(0.17mol)及9mL水,冷却至室温,再加入溴化钠15.5g(0.15mol)和几粒碎瓷片;
③小心加热,使其充分反应;
④再经过一系列操作制得纯净的溴乙烷。
试回答下列问题:
(1)图中仪器B的名称为
(2)步骤②中在烧瓶中加入乙醇、浓硫酸及水,三种试剂加入的顺序是
A.先加浓硫酸再加乙醇与水 B.先加乙醇与水,再加浓硫酸 C.三者不分先后
(3)若温度过高,反应中有红棕色气体(
A.乙醇 B.四氯化碳 C.
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水
A.分液 B.蒸馏 C.萃取
(5)水槽中采用冰水浴的原因是
(6)最后收集到溴乙烷10.0g,则该实验中澳乙烷的产率为
己二酸(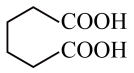 )是一种重要的化工原料和合成中间体。某实验小组以钨磷酸为催化剂,开展己二酸的合成及性质探究实验。
)是一种重要的化工原料和合成中间体。某实验小组以钨磷酸为催化剂,开展己二酸的合成及性质探究实验。
Ⅰ.催化剂钨磷酸晶体(H3PW12O40)的制备
实验流程如图:

(1)操作Ⅰ所需的玻璃仪器除烧杯外还有___________ ,乙醚的作用为 ___________ 。
(2)水层中的物质有大量NaCl和少量HCl,步骤①中发生反应的化学方程式是___________ 。
Ⅱ.己二酸的合成
向三颈烧瓶中加入0.10g钨磷酸催化剂和30mL30%双氧水,在室温下搅拌5min,然后加入5.0mL试剂X,得到溶液A。
(3)环己烯、环己醇、环己酮均可被双氧水氧化成己二酸。仅从所需双氧水理论用量的角度看,试剂X的最佳选择是________ (填序号)。
A.环己烯(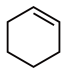 ) B.环己醇(
) B.环己醇(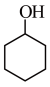 ) C.环己酮(
) C.环己酮(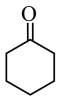 )
)
(4)如图是己二酸的浓度与温度关系曲线图。介稳区表示己二酸溶液处于饱和状态,稳定区表示己二酸溶液处于不饱和状态。实验室常根据直线EHI从溶液A获取己二酸晶体,对应的实验操作为___________ ,过滤。

Ⅲ.己二酸的性质探究
以己二酸和乙醇为原料,用如图所示装置制备己二酸二乙酯。
步骤1:向如图所示的装置A中加入30mL乙醇、10mL己二酸、0.6mL浓硫酸、10mL苯和2~3片碎瓷片。组装好仪器,并预先在分水器内加入一定量水,开始缓慢加热A(沸点65℃),加热回流1h,直至反应基本完成。
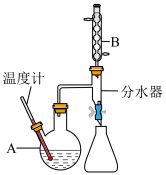
步骤 2:待反应液冷却至室温后倒入分液漏斗中,洗涤干燥后蒸馏,收集相应馏分,得到己二酸 二乙酯 9.6 g。
(5)装置中分水器的作用是________ ,判断反应已经完成的标志是 ___________ 。
(6)本次实验的产率为(某种生成物的实际产量与理论产量的百分比)___________ 。(结果保留两位有效数字)
 )是一种重要的化工原料和合成中间体。某实验小组以钨磷酸为催化剂,开展己二酸的合成及性质探究实验。
)是一种重要的化工原料和合成中间体。某实验小组以钨磷酸为催化剂,开展己二酸的合成及性质探究实验。Ⅰ.催化剂钨磷酸晶体(H3PW12O40)的制备
实验流程如图:

(1)操作Ⅰ所需的玻璃仪器除烧杯外还有
(2)水层中的物质有大量NaCl和少量HCl,步骤①中发生反应的化学方程式是
Ⅱ.己二酸的合成
向三颈烧瓶中加入0.10g钨磷酸催化剂和30mL30%双氧水,在室温下搅拌5min,然后加入5.0mL试剂X,得到溶液A。
(3)环己烯、环己醇、环己酮均可被双氧水氧化成己二酸。仅从所需双氧水理论用量的角度看,试剂X的最佳选择是
A.环己烯(
 ) B.环己醇(
) B.环己醇( ) C.环己酮(
) C.环己酮( )
)(4)如图是己二酸的浓度与温度关系曲线图。介稳区表示己二酸溶液处于饱和状态,稳定区表示己二酸溶液处于不饱和状态。实验室常根据直线EHI从溶液A获取己二酸晶体,对应的实验操作为

Ⅲ.己二酸的性质探究
以己二酸和乙醇为原料,用如图所示装置制备己二酸二乙酯。
步骤1:向如图所示的装置A中加入30mL乙醇、10mL己二酸、0.6mL浓硫酸、10mL苯和2~3片碎瓷片。组装好仪器,并预先在分水器内加入一定量水,开始缓慢加热A(沸点65℃),加热回流1h,直至反应基本完成。

步骤 2:待反应液冷却至室温后倒入分液漏斗中,洗涤干燥后蒸馏,收集相应馏分,得到己二酸 二乙酯 9.6 g。
| 有机物名称 | 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 溶解性 |
| 己二酸 | 146 | 1.36 | 330 | 微溶于水,易溶于乙醇 |
| 乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
| 己二酸二乙酯 | 202 | 1.00 | 247 | 难溶于水、易溶于乙醇 |
| 苯 | 78 | 0.88 | 80.1 | 难溶于水 |
(5)装置中分水器的作用是
(6)本次实验的产率为(某种生成物的实际产量与理论产量的百分比)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


