填空题 困难0.15 引用1 组卷187
盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
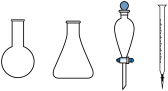
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
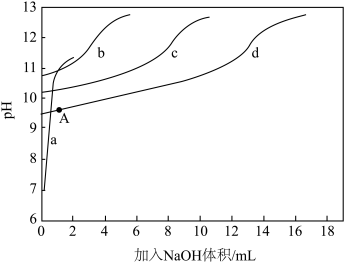
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
2024·广东惠州·三模
类题推荐
常温下有0.1mol·L-1四种溶液NaOH、NH3·H2O、HCl、CH3COOH。
(1)已知CH3COOH溶液的pH=3,其电离度为____ 。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线___ ,a、b两点中,导电能力更强的是____ 。

(3)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)>V(HCl),当溶液中c(NH3·H2O)=c(NH )时,溶液的pH=
)时,溶液的pH=___ 。[已知:Kb(NH3·H2O)=1.77×10-5,lg1.77=0.25]
(4)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达到平衡时的离子浓度,B点表示100℃时水的电离达到平衡时的离子浓度。
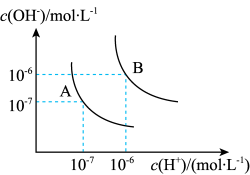
①100℃时0.1mol·L-1NaOH溶液中,由水电离出的c(H+)=___ mol·L-1,Kw(25℃)____ Kw(100℃)(填“>”“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,溶液呈酸性的原因是___ (用离子方程式及必要的文字说明)。
(5)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据:
25℃时,有等浓度的a.NaCN溶液b.CH3COONa溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为___ (填序号)。
(1)已知CH3COOH溶液的pH=3,其电离度为
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线

(3)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)>V(HCl),当溶液中c(NH3·H2O)=c(NH
(4)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达到平衡时的离子浓度,B点表示100℃时水的电离达到平衡时的离子浓度。

①100℃时0.1mol·L-1NaOH溶液中,由水电离出的c(H+)=
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,溶液呈酸性的原因是
(5)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.75×10-5 |
| H2CO3 | K1=4.4×10-7、K2=4.7×10-11 |
25℃时,有等浓度的a.NaCN溶液b.CH3COONa溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为
某小组设计了如下实验探究某未知浓度的酸HA相关性质。
(1)25℃时,配制不同浓度HA溶液,并测其pH值,所得相关数据如下:
据此小组同学得出HA为弱电解质的结论,理由是___________ 。
(2)25℃,将pH=2的HA溶液与pH=12的NaOH溶液等体积混合,下列说法正确的是________ (填序号)。
a.混合后离子浓度满足等式:
b.混合后会生成强碱弱酸盐NaA,因其水解而使混合后的溶液显碱性
c.pH=2的HA溶液中,由水电离出的H+浓度为10-2mo1/L
d.pH=12的NaOH溶液中,由水电离出的H+浓度为10-12mol/L
(3)25℃时,向HA溶液中加入NaOH,配制 的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数
的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数 与所加NaOH物质的量的关系如图所示。
与所加NaOH物质的量的关系如图所示。
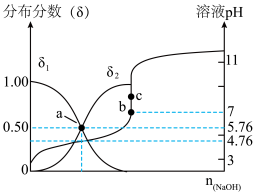
①δ1表示___________ (填微粒符号)的分布分数曲线。
②25℃时,HA的电离平衡常数Ka=___________ (已知100.24=1.75)。
③pH=5时,溶液中A-的浓度和HA的浓度之比为c(A-):c(HA)=___________ 。
④若c处c(Na+)=0.1mol/L,则a、b、c三处水的电离程度由大到小排序为___________ 。
(4)查阅资料可知,若往某溶液中加入少量强酸或强碱时,外来的H+或OH-中绝大多数被溶液中某些微粒消耗掉从而导致pH几乎不变的为缓冲溶液。据此小组同学推断(3)中a点对应溶液为缓冲溶液。原因是向a点溶液加入少量酸,外来的H+被A-消耗;加少量碱,外来的OH-被___________ 消耗,导致溶液中游离的H+浓度几乎不变,溶液的pH也几乎不变。
(5)下列浓度比均为1:1的混合溶液中与a点溶液相似,也属于缓冲溶液的是________ (填序号)
a.Na2CO3-NaHCO3 b.H2SO4-Na2SO4 c.NaOH-NaCl d.NH3∙H2O-NH4Cl
(1)25℃时,配制不同浓度HA溶液,并测其pH值,所得相关数据如下:
| 序号 | 原HA溶液体积/mL | 水的体积/mL | pH |
| I | 40.00 | / | 2.88 |
| II | 4.00 | 36.0 | 3.38 |
(2)25℃,将pH=2的HA溶液与pH=12的NaOH溶液等体积混合,下列说法正确的是
a.混合后离子浓度满足等式:
b.混合后会生成强碱弱酸盐NaA,因其水解而使混合后的溶液显碱性
c.pH=2的HA溶液中,由水电离出的H+浓度为10-2mo1/L
d.pH=12的NaOH溶液中,由水电离出的H+浓度为10-12mol/L
(3)25℃时,向HA溶液中加入NaOH,配制

①δ1表示
②25℃时,HA的电离平衡常数Ka=
③pH=5时,溶液中A-的浓度和HA的浓度之比为c(A-):c(HA)=
④若c处c(Na+)=0.1mol/L,则a、b、c三处水的电离程度由大到小排序为
(4)查阅资料可知,若往某溶液中加入少量强酸或强碱时,外来的H+或OH-中绝大多数被溶液中某些微粒消耗掉从而导致pH几乎不变的为缓冲溶液。据此小组同学推断(3)中a点对应溶液为缓冲溶液。原因是向a点溶液加入少量酸,外来的H+被A-消耗;加少量碱,外来的OH-被
(5)下列浓度比均为1:1的混合溶液中与a点溶液相似,也属于缓冲溶液的是
a.Na2CO3-NaHCO3 b.H2SO4-Na2SO4 c.NaOH-NaCl d.NH3∙H2O-NH4Cl
常温下有下列溶液①0.10mol·L-1盐酸 ②0.10 mol·L-1H2SO4溶液 ③0.10mol·L-1氨水 ④0.10 mol·L-1NaC1溶液 ⑤0.10mol·L-1NaOH溶液。
(1)溶液⑤中由水电离出的H+浓度为_______ mol/L,若将⑤溶液稀释25倍后,溶液的pH值变为_______ 。
(2)中和相同体积的③和⑤溶液,所需溶液①的体积_______。
(3)一定温度下,将一定质量冰醋酸加水稀释过程中溶液的导电能力变化如图所示。

①a、b、c三点对应的溶液中,CH3COOH电离程度最大的是_______ 。
A.a B.b C.c
②a、b、c三点对应的溶液中,(H+)最大的是_______ 。
A.a B.b C.c
③a、b、c三点溶液用1 NaOH溶液中和,分别消耗NaOH溶液体积Va、Vb、Vc大小的关系
NaOH溶液中和,分别消耗NaOH溶液体积Va、Vb、Vc大小的关系_______ 。
(4)某温度下,向氨水溶液中加入少量氯化铵固体,则NH3·H2O电离度_______ ,溶液中(NH )
)_______ ,c(OH-)_______ ,由NH3·H2O电离出的(NH )
)_______ 水的离子积⑤_______ 。
A.变大 B.变小 C.不变 D.无法确定
(5)25℃时,若将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,并使混合后溶液pH=7,则NaOH溶液与H2SO4的体积比为_______ 。
(6)一定温度时,部分弱酸的电离平衡常数如下表所示:
①相同条件下,pH相等的HSCN溶液和HCN溶液,_______ 的浓度更大。
A.HSCN溶液 B.HCN溶液
②CN-、ClO-、HCO 、CO
、CO 最容易结合H+的是
最容易结合H+的是_______ 。
A.CN- B.ClO- C.HCO D.CO
D.CO
(1)溶液⑤中由水电离出的H+浓度为
(2)中和相同体积的③和⑤溶液,所需溶液①的体积_______。
| A.③需要的多 | B.⑤需要的多 | C.一样多 | D.无法判断 |
(3)一定温度下,将一定质量冰醋酸加水稀释过程中溶液的导电能力变化如图所示。

①a、b、c三点对应的溶液中,CH3COOH电离程度最大的是
A.a B.b C.c
②a、b、c三点对应的溶液中,(H+)最大的是
A.a B.b C.c
③a、b、c三点溶液用1
(4)某温度下,向氨水溶液中加入少量氯化铵固体,则NH3·H2O电离度
A.变大 B.变小 C.不变 D.无法确定
(5)25℃时,若将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,并使混合后溶液pH=7,则NaOH溶液与H2SO4的体积比为
(6)一定温度时,部分弱酸的电离平衡常数如下表所示:
| 化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
| 电离常数 |
A.HSCN溶液 B.HCN溶液
②CN-、ClO-、HCO
A.CN- B.ClO- C.HCO
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


