解答题-工业流程题 较难0.4 引用2 组卷303
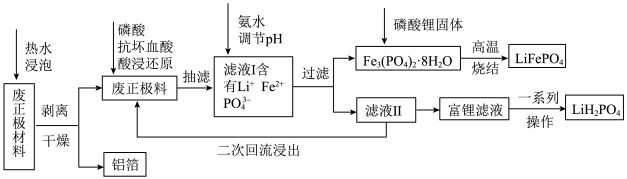
废旧磷酸铁锂电池回收工艺存在价值低、污染大等问题,某科研组创新性地提出还原酸浸-沉淀-固相再生法,具体工艺流程如下:___________ (填化学式,写一种)。
(2)“酸浸还原”过程中需控制反应温度为70℃,其加热方式为___________ (填“水浴”、“油浴”或“沙浴”)加热。抗坏血酸为有机弱酸,其转化如图a所示。加入抗坏血酸的目的是___________ ,每1mol抗坏血酸参与反应时转移___________ mole-。
(3)在通入氩气的气氛下,向滤液Ⅰ中加入氨水,当调节pH=6.5时,沉淀样品经___________ 实验来分析晶体结构,与Fe3(PO4)2·8H2O的标准卡片吻合。若pH过高,则晶体不纯,可能的原因是___________ 。
(4)“富锂滤液”经蒸发浓缩、冷却结晶、过滤、洗涤、干燥即得到LiH2PO4,在该实验操作过程中不会利用到的仪器有___________ (填字母)。
A.蒸发皿 B.容量瓶 C.玻璃棒 D.直形冷凝管 E.烧杯
(5)已知在该过程中,金属铁元素的浸出率为98.1%、沉淀率为98.2%,则铁元素的总回收率为___________ %(保留三位有效数字)。
(6)某科研团队以Li2SO4和LiOH溶液分别作为阳极室和阴极室的电解液(电极均为惰性电极),将废旧磷酸铁锂粉末悬浮在阳极室中进行悬浮电解,如图b所示:则阴极室的电极反应方程式为:___________ 。
(2)“酸浸还原”过程中需控制反应温度为70℃,其加热方式为
(3)在通入氩气的气氛下,向滤液Ⅰ中加入氨水,当调节pH=6.5时,沉淀样品经
(4)“富锂滤液”经蒸发浓缩、冷却结晶、过滤、洗涤、干燥即得到LiH2PO4,在该实验操作过程中不会利用到的仪器有
A.蒸发皿 B.容量瓶 C.玻璃棒 D.直形冷凝管 E.烧杯
(5)已知在该过程中,金属铁元素的浸出率为98.1%、沉淀率为98.2%,则铁元素的总回收率为
(6)某科研团队以Li2SO4和LiOH溶液分别作为阳极室和阴极室的电解液(电极均为惰性电极),将废旧磷酸铁锂粉末悬浮在阳极室中进行悬浮电解,如图b所示:则阴极室的电极反应方程式为:

2024·辽宁抚顺·模拟预测
类题推荐
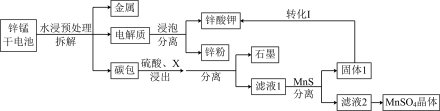
我国是干电池的生产和消费大国。某科研团队设计了以下流程对废旧碱性锌锰干电池的资源进行回收:
已知:
①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
③ 0.1 mol/L NaHCO3溶液的pH约为8;0.1 mol/L Na2CO3溶液的pH约为11。
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为:2MnO2+Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式________________________________ ;
(2)为了提高碳包的浸出效率,可以采取的措施有______________________________ ;(写一条即可)
(3)向滤液1中加入MnS的目的是__________________________________________ ;
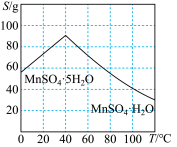
(4)已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________ 、洗涤、低温干燥;
(5)为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如下表,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式________________ 。
(6)工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是_______________________________________ ;
(7)该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定,测定Mn元素在电池中的质量百分数。
实验过程如下:
①将一节废旧碱性锌锰干电池拆解后,去除金属、碳棒以及外包装后;
②准确称取固体粉末1.200 g;
③经过水浸…等步骤得到滤液1(<100 mL);
④将滤液1稀释至100.00 mL;
⑤取20.00 mL溶液用0.0500 mol•L-1EDTA标准溶液滴定;在一定条件下,只发生反应:Mn2++Y2-=MnY。
⑥重复滴定3次,平均消耗标准溶液22.00 mL。
则Mn元素的质量百分数为________ 。(保留3位有效数字)

已知:
①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
③ 0.1 mol/L NaHCO3溶液的pH约为8;0.1 mol/L Na2CO3溶液的pH约为11。
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为:2MnO2+Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式
(2)为了提高碳包的浸出效率,可以采取的措施有
(3)向滤液1中加入MnS的目的是
(4)已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、

(5)为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如下表,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.4 |
| 2 | 铁粉 | 2.7 |
| 3 | FeS粉末 | 3.0 |
| 4 | 30%过氧化氢 | 3.7 |
(6)工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是
(7)该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定,测定Mn元素在电池中的质量百分数。
实验过程如下:
①将一节废旧碱性锌锰干电池拆解后,去除金属、碳棒以及外包装后;
②准确称取固体粉末1.200 g;
③经过水浸…等步骤得到滤液1(<100 mL);
④将滤液1稀释至100.00 mL;
⑤取20.00 mL溶液用0.0500 mol•L-1EDTA标准溶液滴定;在一定条件下,只发生反应:Mn2++Y2-=MnY。
⑥重复滴定3次,平均消耗标准溶液22.00 mL。
则Mn元素的质量百分数为
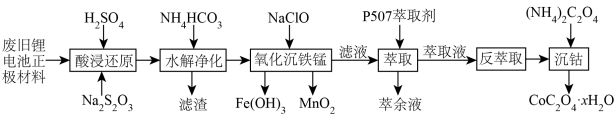
某锂离子二次电池的正极材料主要为LiCoO2,还含有少量Al、Fe、Mn、Ni的化合物。通过如图流程利用废旧锂离子电池制备草酸钴晶体(CoC2O4•xH2O):
已知该工艺条件下,有关金属离子沉淀完全(c=1×10-5mol•L-1)的pH见表:
回答下列问题:
(1)“酸浸还原”步骤,LiCoO2发生的反应中氧化产物为硫酸盐,则氧化剂与还原剂的物质的量之比为________ 。
(2)“滤渣”成分是________ 。“水解净化”时,温度不宜超过70℃,原因是________ 。
(3)“氧化沉铁锰”中,反应生成MnO2的离子方程式为________ 。
(4)利用“P507萃取剂”从“滤液”中分离Co2+。研究水相pH对金属离子分离的影响,所得结果如图所示,其中分离因素β越大,表明萃取剂对不同离子分离效果越好。
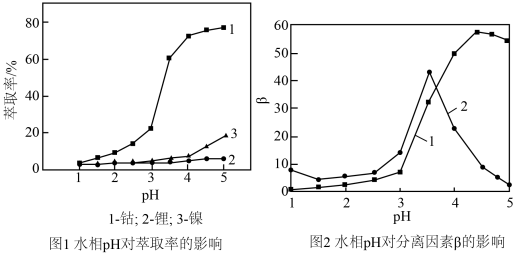
由图可知,萃取时的最佳水相pH为________ (填字母)。
(5)“沉钴”适宜温度为50℃,温度过高会使Co2+沉淀率下降,可能的原因是________ 。
(6)采用热重分析法测定草酸钴晶体样品所含结晶水数目,将样品加热到140℃时失掉1个结晶水,失重9.84%。CoC2O4•xH2O中x=________ 。

已知该工艺条件下,有关金属离子沉淀完全(c=1×10-5mol•L-1)的pH见表:
| 离子 | Co2+ | Fe3+ | Fe2+ | Al3+ | Mn2+ | Ni2+ |
| pH | 9.3 | 3.2 | 9.0 | 4.7 | 10.1 | 8.9 |
(1)“酸浸还原”步骤,LiCoO2发生的反应中氧化产物为硫酸盐,则氧化剂与还原剂的物质的量之比为
(2)“滤渣”成分是
(3)“氧化沉铁锰”中,反应生成MnO2的离子方程式为
(4)利用“P507萃取剂”从“滤液”中分离Co2+。研究水相pH对金属离子分离的影响,所得结果如图所示,其中分离因素β越大,表明萃取剂对不同离子分离效果越好。

由图可知,萃取时的最佳水相pH为
| A.2.5 | B.3.0 | C.3.5 | D.4.0 |
(5)“沉钴”适宜温度为50℃,温度过高会使Co2+沉淀率下降,可能的原因是
(6)采用热重分析法测定草酸钴晶体样品所含结晶水数目,将样品加热到140℃时失掉1个结晶水,失重9.84%。CoC2O4•xH2O中x=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




