解答题-原理综合题 适中0.65 引用1 组卷132
I.回答下列问题
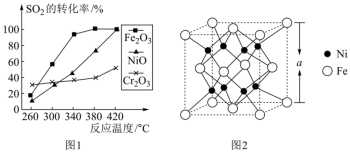
(1)其他条件相同、催化剂不同时发生反应2CO(g)+SO2(g) S(l)+2CO2(g)。SO2的转化率随反应温度的变化如图1所示,由图分析,选择
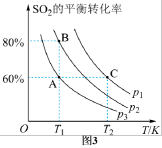
S(l)+2CO2(g)。SO2的转化率随反应温度的变化如图1所示,由图分析,选择___________ 做催化剂最好。某种铁镍合金的立方晶胞如图2所示,镍原子的配位数为___________ ;该合金的化学式为___________ 。___________ ;A点对应条件下
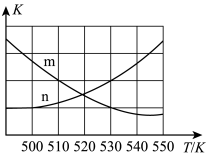
___________ [对于反应mA(g)+nB(g) pC(g)+qD(g),
pC(g)+qD(g), ,x为物质的量分数]。
,x为物质的量分数]。
Ⅱ.CO2催化加氢制取甲醇 ,反应如下:
,反应如下:
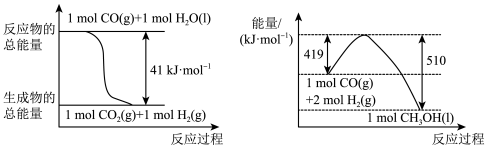
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H=-49.01kJ/mol
CH3OH(g)+H2O(g) ∆H=-49.01kJ/mol
副反应:CO2(g)+H2(g) CO(g)+H2O(g) ∆H=+41.17kJ/mol
CO(g)+H2O(g) ∆H=+41.17kJ/mol
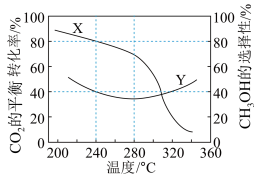
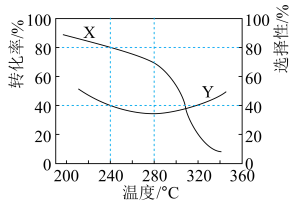
在一定条件下,向某1L恒容密闭容器中充入1mol CO2和a molH2发生反应。实验测得CO2的平衡转化率和平衡时的选择性随温度变化如图所示。 。
。
(3)图中表示平衡时 的选择性的曲线为
的选择性的曲线为___________ (填“X”或“Y”);温度低于280℃时,曲线Y随温度升高而下降的原因是___________ 。
(4)240℃时,容器内达到平衡状态时副反应的K=1,则初始充入H2的物质的量a=___________ mol(保留三位有效数字)。
(1)其他条件相同、催化剂不同时发生反应2CO(g)+SO2(g)
Ⅱ.CO2催化加氢制取甲醇
主反应:CO2(g)+3H2(g)
副反应:CO2(g)+H2(g)
在一定条件下,向某1L恒容密闭容器中充入1mol CO2和a molH2发生反应。实验测得CO2的平衡转化率和平衡时的选择性随温度变化如图所示。
(3)图中表示平衡时
(4)240℃时,容器内达到平衡状态时副反应的K=1,则初始充入H2的物质的量a=
2024·湖南怀化·二模
类题推荐
以CO2为碳源选择性加氢合成甲醇一直是研究的热点,涉及的主要反应如下:
i. CO2(g) +3H2(g) CH3OH(g) +H2Og) ΔH1<0
CH3OH(g) +H2Og) ΔH1<0
ii. CO2(g) +H2(g) CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2
回答下列问题:
(1)在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,下表为298K时几种物质的标准摩尔生成焓。则△H2 =___________ kJ·mol-1。
(2)反应ii的反应速率v=v正-v逆=k正c(CO2)c(H2)-k逆cm (CO)cn (H2O),其中k正、k逆分别为正、逆反应速率常数。该反应的平衡常数 ,则m=
,则m=___________ ,升高温度时k正-k逆___________ (填 “增大”、“减小”或“不变”)。
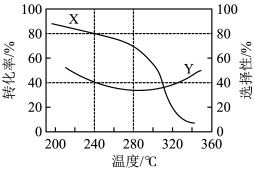
(3)在一定温度下,向1L密闭容器中通入1mol CO2 (g) 和a mol H2 (g) 发生上述反应,起始总压强为21.2MPa。实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度变化如图所示:
已知: CH3OH的选择性= 。
。
①图中表示平衡时CH3OH的选择性的曲线为___________ (填“X”或“Y”),温度高于280°C时,曲线Y随温度升高而升高的原因是___________ 。
②240°C时,反应20min容器内达平衡状态,反应ii的K= ,用CO2表示0 ~ 20min内平均反应速率v(CO2) =
,用CO2表示0 ~ 20min内平均反应速率v(CO2) =___________ , 初始充入H2的物质的量a=___________ mol,反应i的平衡常数Kp=___________ (MPa)-2 (计算结果保留1位小数)。
i. CO2(g) +3H2(g)
ii. CO2(g) +H2(g)
回答下列问题:
(1)在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,下表为298K时几种物质的标准摩尔生成焓。则△H2 =
| 物质 | H2(g) | O2(g) | CO(g) | CO2(g) | H2O(g) |
| 0 | 0 | - 110.5 | - 393.5 | -241.8 |
(3)在一定温度下,向1L密闭容器中通入1mol CO2 (g) 和a mol H2 (g) 发生上述反应,起始总压强为21.2MPa。实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度变化如图所示:

已知: CH3OH的选择性=
①图中表示平衡时CH3OH的选择性的曲线为
②240°C时,反应20min容器内达平衡状态,反应ii的K=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网