解答题-实验探究题 较难0.4 引用1 组卷378
资料显示,I2-KI溶液可以清洗银镜。某小组同学设计实验探究银镜在I2-KI溶液中的溶解情况。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I− I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】_____ 。
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是_____ 。
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
(3)ⅰi中,搅拌后银镜继续溶解的原因是_____ 。
(4)由i、iii可得到的结论是_____ 。
(5)设计iv的目的是_____ 。
探究3:I−的作用
【实验v】
说明:本实验中,检流计读数越大,说明氧化剂氧化性(或还原剂还原性)越强。
(6)步骤1接通电路后,正极的电极反应物为_____ 。
(7)补全步骤3的操作及现象:_____ ,_____ 。
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:_____ 。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I−
探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】
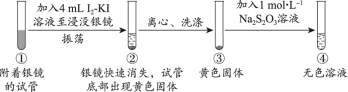
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
| 序号 | 加入试剂 | 实验现象 |
| ⅰi | 4mL饱和碘水(向水中加入I2至饱和, | 30min后,银镜少部分溶解,溶液棕黄色变浅;放置24h后,与紫黑色固体接触部分银镜消失,紫黑色固体表面上有黄色固体,上层溶液接近无色;搅拌后,银镜继续溶解 |
| ⅱi | 4mL饱和碘水和0.66gKI固体(溶液中KI约1mol·L−1) | 15min后银镜部分溶解,溶液棕黄色变浅;放置24h后,试管壁上仍有未溶解的银镜,溶液无色 |
| iv | 4mL1mol·L−1KI溶液 | 放置24h,银镜不溶解,溶液无明显变化 |
(4)由i、iii可得到的结论是
(5)设计iv的目的是
探究3:I−的作用
【实验v】
| 实验装置 | 实验步骤及现象 |
| 1.按左图搭好装置,接通电路,检流计指针向 右微弱偏转,检流计读数为amA; 2.向石墨电极附近滴加饱和碘水,指针继续向 右偏转,检流计读数为bmA(b>a); 3.向左侧烧杯中加入_____,指针继续向右偏转,检流计读数cmA(c>b),有_____生成。 |
(6)步骤1接通电路后,正极的电极反应物为
(7)补全步骤3的操作及现象:
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:
2024·北京·一模
类题推荐
某学习小组探究FeCl3溶液与Na2S溶液在某种条件下的反应。
实验Ⅰ
已知:FeS、Fe2S3均为黑色固体,难溶于水。
(1)用化学用语解释Na2S溶液呈碱性的原因___________ 。
(2)小组同学们试管b中黑色沉淀的提出猜想
猜想1::黑色沉淀是Fe2S3
猜想2::黑色沉淀是FeS
①针对猜想1,甲同学根据Na2S溶液呈碱性,推测试管b中黑色沉淀除Fe2S3外,还可能存在Fe(OH)3,补充实验II如下:
②甲同学继续查找数据:Ksp[Fe2S3]=1.0×10-88,Ksp[Fe(OH)3]=1.1×10-36,设计实验III:向Fe(OH)3中加入过量pH=12.5的0.1mol·L-1Na2S溶液,观察到的现象是沉淀颜色由___________ ,该现象对应的离子方程式为___________ 。
③针对猜想2,乙同学推测,若猜想2成立,应该还有S生成。写出该同学推测所依据的离子方程式___________ 。乙同学继续检验:进行实验并获取证据:取试管b中黑色沉淀,用水多次洗涤后,___________ ,确认黑色沉淀中无S单质,猜想2不成立。
(已知:Ksp(FeS)=1.59×10-19;H2S:Ka1=9.5×10-8,Ka2=1.3×10-14)
(3)丙同学利用电化学原理继续进行探究
丙同学依据实验IV得出结论:pH=1的0.1mol·L-1FeCl3溶液与pH=12.5的0.1mol·L-1Na2S溶液___________ (填“能”或“不能”)发生氧化还原反应。
(4)综合以上研究,从反应原理角度分析试管b中黑色沉淀是Fe2S3而不是FeS的原因:___________ 。
实验Ⅰ

已知:FeS、Fe2S3均为黑色固体,难溶于水。
(1)用化学用语解释Na2S溶液呈碱性的原因
(2)小组同学们试管b中黑色沉淀的提出猜想
猜想1::黑色沉淀是Fe2S3
猜想2::黑色沉淀是FeS
①针对猜想1,甲同学根据Na2S溶液呈碱性,推测试管b中黑色沉淀除Fe2S3外,还可能存在Fe(OH)3,补充实验II如下:
| 编号 | 操作或过程 | 现象和结论 |
| 实验Ⅱ | 向 | 有红褐色溶液生成。试管b中黑色的Fe2S3可能影响Fe(OH)3红褐色的观察。 |
③针对猜想2,乙同学推测,若猜想2成立,应该还有S生成。写出该同学推测所依据的离子方程式
(已知:Ksp(FeS)=1.59×10-19;H2S:Ka1=9.5×10-8,Ka2=1.3×10-14)
(3)丙同学利用电化学原理继续进行探究
| 编号 | 装置 | 操作及现象 |
| 实验IV |  | ①电流计指针有微弱偏转 ②2分钟后,取左侧烧杯溶液,滴加K3[Fe(CN)6]溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加K3[Fe(CN)6]溶液,有大量蓝色沉淀。 |
(4)综合以上研究,从反应原理角度分析试管b中黑色沉淀是Fe2S3而不是FeS的原因:
向KI溶液中持续通入Cl2,发现溶液先由无色变为棕黄色,一段时间后褪色。探究溶液变色的原因。
(1)溶液变为棕黄色的原因是KI被Cl2氧化为I2,离子方程式是____ 。
[猜测]棕黄色褪去的原因是I2被氧化,氧化产物中I的化合价记为+x。
[实验Ⅰ]设计如表实验验证I2被氧化
(2)①本实验中,试剂a作____ 剂(填“氧化”或“还原”)。
②甲能证实I2被氧化而乙不能,原因是____ 。
[实验Ⅱ]通过如下实验可测定x
i.取vmLcmol·L-1KI溶液于锥形瓶中,通入过量Cl2至棕黄色褪去。
ii.边搅拌边加热锥形瓶中的溶液,一段时间后,操作A,试纸不变蓝。
iii.冷却至室温后,加入过量KI固体,生成大量紫黑色沉淀(I2)。
iv.立即用amol·L-1Na2S2O3溶液滴定。滴定过程中沉淀逐渐溶解,溶液颜色逐渐变深再变浅。当溶液变为浅黄色时,加入淀粉溶液,继续滴定至终点,消耗Na2S2O3溶液bmL。
已知:I2+2S2O =S4O
=S4O +2I-
+2I-
I-+I2 I
I (棕黄色)
(棕黄色)
I2在纯水中溶解度很小,饱和碘水呈浅黄色
(3)ii的目的是除去溶液中的Cl2,操作A是____ 。
(4)结合数据,计算可得x=____ (用代数式表示)。
[反思]
(5)实验过程中,在未知x具体数值的情况下,iii中为保证所加的KI固体过量,理论上加入的n(KI)应大于i中n(KI)的____ (填数字)倍。
(6)从平衡移动的角度解释iv中“溶液颜色逐渐变深再变浅”的原因:____ 。
(1)溶液变为棕黄色的原因是KI被Cl2氧化为I2,离子方程式是
[猜测]棕黄色褪去的原因是I2被氧化,氧化产物中I的化合价记为+x。
[实验Ⅰ]设计如表实验验证I2被氧化
| 装置 | 序号 | 试剂a | 现象 |
 | 甲 | Na2SO3溶液 | 溶液均变黄,遇淀粉变蓝 |
| 乙 | KI溶液 |
②甲能证实I2被氧化而乙不能,原因是
[实验Ⅱ]通过如下实验可测定x
i.取vmLcmol·L-1KI溶液于锥形瓶中,通入过量Cl2至棕黄色褪去。
ii.边搅拌边加热锥形瓶中的溶液,一段时间后,操作A,试纸不变蓝。
iii.冷却至室温后,加入过量KI固体,生成大量紫黑色沉淀(I2)。
iv.立即用amol·L-1Na2S2O3溶液滴定。滴定过程中沉淀逐渐溶解,溶液颜色逐渐变深再变浅。当溶液变为浅黄色时,加入淀粉溶液,继续滴定至终点,消耗Na2S2O3溶液bmL。
已知:I2+2S2O
I-+I2
I2在纯水中溶解度很小,饱和碘水呈浅黄色
(3)ii的目的是除去溶液中的Cl2,操作A是
(4)结合数据,计算可得x=
[反思]
(5)实验过程中,在未知x具体数值的情况下,iii中为保证所加的KI固体过量,理论上加入的n(KI)应大于i中n(KI)的
(6)从平衡移动的角度解释iv中“溶液颜色逐渐变深再变浅”的原因:
某兴趣小组设计相关实验方案对Cu2+、Ag+氧化性的强弱进行探究。
已知:① ;
;

I.溶液准备
(1)配制 溶液,需使用的玻璃仪器有烧杯、胶头滴管、
溶液,需使用的玻璃仪器有烧杯、胶头滴管、___________ 、___________ ,测得该溶液的pH≈4。
II.通过置换反应比较
(2)向 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性 写出该反应的化学方程式是
写出该反应的化学方程式是___________ 。
Ⅲ.通过 分别与同一物质反应进行比较
分别与同一物质反应进行比较
(3)①经检验,实验i中反应后溶液不含I2,则该反应产生的黄色沉淀是___________ 。
②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有___________ (填离子符号)。
b.白色沉淀A与AgNO3溶液反应的离子方程式是___________ ,说明氧化性
(4)分析“实验i”中Ag+未能氧化I-,而“实验ii”中Cu2+能氧化I-的原因。
①结合K值分析:因___________ ,Ag+更易与I-发生复分解反应,生成AgI,故Ag+未能氧化I-;
②结合实验ii的反应方程式及其特点分析:___________ ,促进反应向正反应方向进行,故Cu2+能更易氧化I⁻。
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为 d中是
d中是 Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
(5)①实验v的现象说明Ag+能氧化Γ,a中溶液呈棕黄色的原因是___________ (用电极反应式表示)。
②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是___________ ,现象是c中溶液较慢变浅黄色;电流计指针偏转。
小组同学根据实验v和实验vi,可推断氧化性
已知:①
I.溶液准备
(1)配制
II.通过置换反应比较
(2)向
Ⅲ.通过
| 编号 | 实验操作 | 现象 |
| 实验i | 向1.0mL1.0mol·L-1KI溶液中滴加1.0mL1.0mol·L-1AgNO3溶液 | 产生黄色沉淀,溶液无色 |
| 实验ii | 向1.0mL1.0mol·L-1KI溶液中滴加1.0mL0.5mol·L-1Cu(NO3)2溶液 | 产生白色沉淀A,溶液变黄色 |
②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有
b.白色沉淀A与AgNO3溶液反应的离子方程式是
(4)分析“实验i”中Ag+未能氧化I-,而“实验ii”中Cu2+能氧化I-的原因。
①结合K值分析:因
②结合实验ii的反应方程式及其特点分析:
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为
| 编号 | 实验iv | 实验v | 实验vi |
| 装置 | 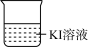 | 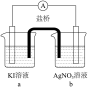 | 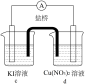 |
| 现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色;电流计指针偏转 |
②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是
小组同学根据实验v和实验vi,可推断氧化性
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



