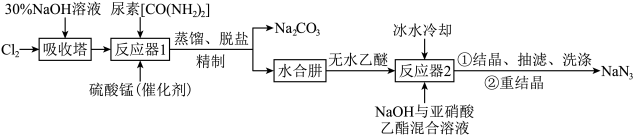
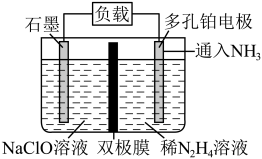
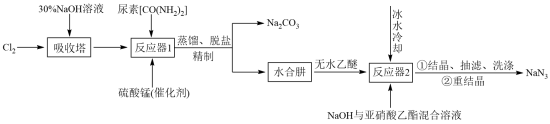
解答题-工业流程题 较易0.85 引用1 组卷39
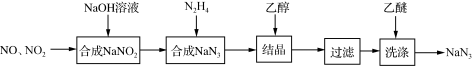
叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。___________ 。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为___________ ,1mol该阴离子中所含的电子总数为___________ mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的还原剂为___________ (填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___________ ?(写出计算过程,保留一位小数,不考虑固体的体积)。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3
①该反应中的还原剂为
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克
23-24高一下·陕西安康·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网