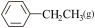解答题-原理综合题 较难0.4 引用1 组卷136
聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
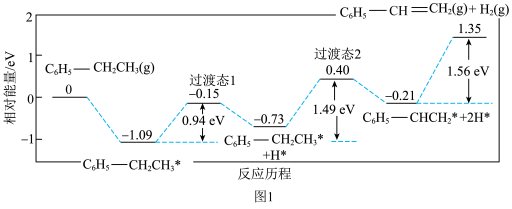
I.工业常采用乙苯脱氢的方法制备苯乙烯,其原理为:C6H5-CH2CH3(g) C6H5-CH=CH2(g)+H2(g)
C6H5-CH=CH2(g)+H2(g)  。通过计算机模拟一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
。通过计算机模拟一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
(2)写出该反应历程(过渡态1和2中)的决速步骤反应方程式:___________ 。
(3)实验测得乙苯脱氢反应的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为速率常数,只与温度有关),图2中③代表lgk逆随 的变化关系,则能代表lgk正随
的变化关系,则能代表lgk正随 的变化关系的是___________。
的变化关系的是___________。
(4)某温度下,向1.0L恒容密闭容器中充入0.10mol C6H5-CH2CH3(g),测得乙苯脱氢反应时间(t)与容器的气体总压强(p)的数据见表:
该温度下的浓度平衡常数K=___________ mol/L(结果保留至小数点后两位)。
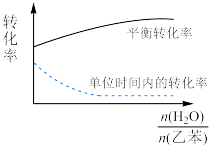
(5)实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),乙苯的转化率随稀释比 的变化如图所示,说明乙苯转化率变化的原因。
的变化如图所示,说明乙苯转化率变化的原因。___________
又已知水的汽化热为40.8kJ·mol-1。根据以上数据,计算CO2氧化乙苯脱氢反应的 =
=___________ 。
(7)该反应在催化剂表面发生的历程如图所示:___________ ;pH过高时,___________ 。
(8)相对于乙苯脱氢法,CO2氧化法制备苯乙烯工艺的优点为合成速率快、单位时间内的产量高;其缺点为:①反应需要控制酸度,工艺较为复杂;②___________ ;③___________ 。
I.工业常采用乙苯脱氢的方法制备苯乙烯,其原理为:C6H5-CH2CH3(g)
| A.大于0 | B.等于0 | C.小于0 | D.无法确定 |
(2)写出该反应历程(过渡态1和2中)的决速步骤反应方程式:
(3)实验测得乙苯脱氢反应的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为速率常数,只与温度有关),图2中③代表lgk逆随

| A.① | B.② | C.④ | D.⑤ |
(4)某温度下,向1.0L恒容密闭容器中充入0.10mol C6H5-CH2CH3(g),测得乙苯脱氢反应时间(t)与容器的气体总压强(p)的数据见表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.26 | 9.32 | 9.33 | 9.33 |
(5)实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),乙苯的转化率随稀释比
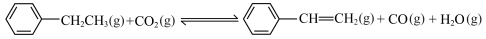
| 物质 |
|
| CO(g) |
| 燃烧热/kJ·mol-1 | -4610.2 | -4376.9 | -283.5 |
(7)该反应在催化剂表面发生的历程如图所示:
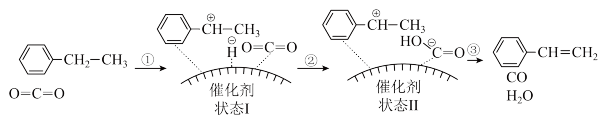
(8)相对于乙苯脱氢法,CO2氧化法制备苯乙烯工艺的优点为合成速率快、单位时间内的产量高;其缺点为:①反应需要控制酸度,工艺较为复杂;②
23-24高三下·上海·阶段练习
类题推荐
聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。回答下列问题:
I.苯乙烯的制备
(1)工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应甲:C6H5-CH2CH3(g)⇌C6H5-CH=CH2(g)+H2(g) ΔH1
近期科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
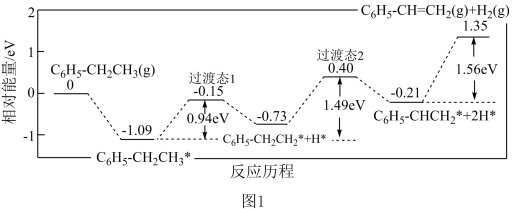
乙苯脱氢制苯乙烯反应的焓变ΔH1___________ 0(选填“大于”或“小于”或“等于”),该反应历程的决速步骤反应方程式为___________ 。
(2)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0L恒容密闭容器中充入0.10molC6H5CH2CH3(g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
计算该温度下的平衡常数K=___________ (结果保留至小数点后两位)。
(3)在913K、100kPa下,以水蒸气作稀释气。Fe2O3作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
反应乙:C6H5C2H5(g)⇌C6H6(g)+CH2=CH2(g)
反应丙:C6H5C2H5(g)+H2(g)⇌C6H5CH3(g)+CH4(g)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S随乙苯转化率的变化曲线如图2所示,其中曲线b代表的产物是___________ ,理由是___________ 。(S=转化为目的产物所消耗乙苯的量100%)

(4)实验测得,乙苯脱氢反应的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为速率
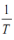 常数,只与温度有关),图3中③代表lgk逆随
常数,只与温度有关),图3中③代表lgk逆随 的变化关系,则能代表lgk正随
的变化关系,则能代表lgk正随 的变化关系的是
的变化关系的是___________ 。
II.苯乙烯的聚合
(5)苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(I)的配合物促进,CuCl是合成该Cu(I)的配合物的关键物质。在CuCl的晶胞中,Cl-的位置如图4所示。Cu+填充于Cl-构成的四面体空隙中,则Cu+的配位数为___________ ;若NA为阿伏加德罗常数的值,该晶体的密度为ρg·cm-3,则该晶胞中Cu+之间的距离为___________ nm(用含ρ、NA的代数式表示)。

I.苯乙烯的制备
(1)工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应甲:C6H5-CH2CH3(g)⇌C6H5-CH=CH2(g)+H2(g) ΔH1
近期科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):

乙苯脱氢制苯乙烯反应的焓变ΔH1
(2)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0L恒容密闭容器中充入0.10molC6H5CH2CH3(g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
(3)在913K、100kPa下,以水蒸气作稀释气。Fe2O3作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
反应乙:C6H5C2H5(g)⇌C6H6(g)+CH2=CH2(g)
反应丙:C6H5C2H5(g)+H2(g)⇌C6H5CH3(g)+CH4(g)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S随乙苯转化率的变化曲线如图2所示,其中曲线b代表的产物是

(4)实验测得,乙苯脱氢反应的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为速率

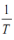 常数,只与温度有关),图3中③代表lgk逆随
常数,只与温度有关),图3中③代表lgk逆随
II.苯乙烯的聚合
(5)苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(I)的配合物促进,CuCl是合成该Cu(I)的配合物的关键物质。在CuCl的晶胞中,Cl-的位置如图4所示。Cu+填充于Cl-构成的四面体空隙中,则Cu+的配位数为

苯乙烯是生产塑料与合成橡胶的重要原料。CO2氧化乙苯脱氢制苯乙烯的反应为:
反应I: (g)+CO2(g)
(g)+CO2(g)
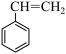 (g)+H2O(g)+CO(g) △H1
(g)+H2O(g)+CO(g) △H1
反应II: (g)
(g)
 (g)+H2(g) △H2
(g)+H2(g) △H2
反应III:CO2(g)+H2(g)=CO(g)+H2O(g) △H3=+41.2kJ•mol-1
回答下列问题:
(1)已知部分物质的燃烧热数据如表,利用表中数据计算△H2=_______ kJ•moL-1(用a、b、c表示)。
(2)下列关于反应I~III的说法正确的是_______ (填标号)。
(3)在催化剂MxOy作用下,CO2氧化乙苯脱氢制苯乙烯可能存在如图所示反应机理:
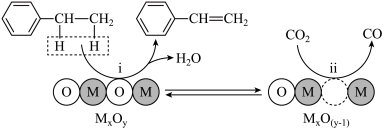
该机理可表示为以下两个反应,请补充反应ii。
i: (g)+MxOy(s)→
(g)+MxOy(s)→ (g)+MxO(y-1)(s)+H2O(g);
(g)+MxO(y-1)(s)+H2O(g);
ii:_______ 。
(4)常压下,乙苯和CO2经催化剂吸附后才能发生上述反应I。控制投料比[n(CO2)∶n(乙苯)]分别为1:1、5:1和10:1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:

①乙苯平衡转化率相同时,投料比越高,对应的反应温度越_______ (填“高”或“低”)。
②相同温度下,投料比远大于10:1时,乙苯的消耗速率明显下降,可能的原因是:i.乙苯的浓度过低;ii._______ 。
③850K时,反应经tmin达到图中P点所示状态,若初始时乙苯的物质的量为nmol,则v(苯乙烯)=______ mol•min-1。
(5)700K时,向恒容密闭容器中加入过量CaCO3和一定量乙苯,一定条件下发生反应I,初始和平衡时容器内压强分别为p1kPa和p2kPa,则平衡时苯乙烯的分压为_______ kPa(以含有p1、p2、p的代数式表示)。[已知:①混合气体中某组分的分压等于总压与该气体物质的量分数之积;以平衡分压代替平衡浓度进行计算,可得反应的分压平衡常数Kp。②CaCO3(s)=CaO(s)+CO2(g) Kp=pkPa]
反应I:
 (g)+CO2(g)
(g)+CO2(g) (g)+H2O(g)+CO(g) △H1
(g)+H2O(g)+CO(g) △H1反应II:
 (g)
(g) (g)+H2(g) △H2
(g)+H2(g) △H2反应III:CO2(g)+H2(g)=CO(g)+H2O(g) △H3=+41.2kJ•mol-1
回答下列问题:
(1)已知部分物质的燃烧热数据如表,利用表中数据计算△H2=
| 物质 | 乙苯 | 苯乙烯 | 氢气 |
| 燃烧热用焓变表示(kJ•mol-1) | -a | -b | -c |
| A.及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量 |
| B.n(CO2)∶n(CO)保持恒定时,说明反应I达到化学平衡状态 |
| C.其他条件相同,反应II分别在恒容和恒压条件下进行,前者乙苯的平衡转化率更高 |
| D.反应III正反应的活化能小于逆反应的活化能 |

该机理可表示为以下两个反应,请补充反应ii。
i:
 (g)+MxOy(s)→
(g)+MxOy(s)→ (g)+MxO(y-1)(s)+H2O(g);
(g)+MxO(y-1)(s)+H2O(g);ii:
(4)常压下,乙苯和CO2经催化剂吸附后才能发生上述反应I。控制投料比[n(CO2)∶n(乙苯)]分别为1:1、5:1和10:1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:

①乙苯平衡转化率相同时,投料比越高,对应的反应温度越
②相同温度下,投料比远大于10:1时,乙苯的消耗速率明显下降,可能的原因是:i.乙苯的浓度过低;ii.
③850K时,反应经tmin达到图中P点所示状态,若初始时乙苯的物质的量为nmol,则v(苯乙烯)=
(5)700K时,向恒容密闭容器中加入过量CaCO3和一定量乙苯,一定条件下发生反应I,初始和平衡时容器内压强分别为p1kPa和p2kPa,则平衡时苯乙烯的分压为
苯乙烯是一种重要的化工原判,可采用乙苯催化脱氢法制备,反应如下:
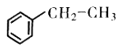 (g)
(g)
 (g)+H2(g)△H
(g)+H2(g)△H
(1)已知
计算上述反应的△H=___ 。
(2)实际生产中往刚性容器中同时通入乙苯和大量水蒸气,控制反应温度为600℃、体系起始总压强为100kPa的条件下进行反应。测得体系总压和乙苯转化率随时间变化结果如图所示。
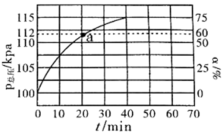
①请用化学平衡理论解释通入大量水蒸气的原因___ 。
②平衡时,p(H2O)=__ kPa,平衡常数Kp=__ kPa(Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)
③反应速率v=v正-v逆=k正·p(乙苯)-k逆·p(苯乙烯)·p(氢气),k正、k逆分别为正、逆反应速率常数。计算a处的 =
=___ 。
(3)苯乙烯与溴化氢发生的加成反应产物有两种,其反应的化学方程式如下:
i.C6H5-CH=CH2(g)+HBr(g) C6H5-CH2CH2Br(g)
C6H5-CH2CH2Br(g)
ii.C6H5-CH=CH2(g)+HBr(g) C6H5-CHBrCH3(g)
C6H5-CHBrCH3(g)
600℃时,向3L恒容密闭容器中充入1.2molC6H5-CH=CH2(g)和1.2molHBr(g)发生反应,达到平衡时C6H5-CH2CH2Br(g)和C6H5-CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。
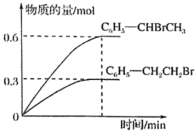
①600℃时,反应ii的化学平衡常数Kii=___ 。
②反应平衡后,若保持其他条件不变,向该容器中再充入1molC6H5-CH2CH2Br(g),则反应ii将__ (填“正向”“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,可以判断反应已达到平衡状态的是__ (填编号)。
A.容器内混合气体的密度不再改变
B.C6H5-CH2CH2Br(g)的生成速率与C6H5-CHBrCH3(g)的分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
 (g)
(g) (g)+H2(g)△H
(g)+H2(g)△H(1)已知
| 化学键 | C—H | C—C | C=C | H—H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
(2)实际生产中往刚性容器中同时通入乙苯和大量水蒸气,控制反应温度为600℃、体系起始总压强为100kPa的条件下进行反应。测得体系总压和乙苯转化率随时间变化结果如图所示。

①请用化学平衡理论解释通入大量水蒸气的原因
②平衡时,p(H2O)=
③反应速率v=v正-v逆=k正·p(乙苯)-k逆·p(苯乙烯)·p(氢气),k正、k逆分别为正、逆反应速率常数。计算a处的
(3)苯乙烯与溴化氢发生的加成反应产物有两种,其反应的化学方程式如下:
i.C6H5-CH=CH2(g)+HBr(g)
ii.C6H5-CH=CH2(g)+HBr(g)
600℃时,向3L恒容密闭容器中充入1.2molC6H5-CH=CH2(g)和1.2molHBr(g)发生反应,达到平衡时C6H5-CH2CH2Br(g)和C6H5-CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。

①600℃时,反应ii的化学平衡常数Kii=
②反应平衡后,若保持其他条件不变,向该容器中再充入1molC6H5-CH2CH2Br(g),则反应ii将
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,可以判断反应已达到平衡状态的是
A.容器内混合气体的密度不再改变
B.C6H5-CH2CH2Br(g)的生成速率与C6H5-CHBrCH3(g)的分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网