解答题-工业流程题 较难0.4 引用2 组卷129
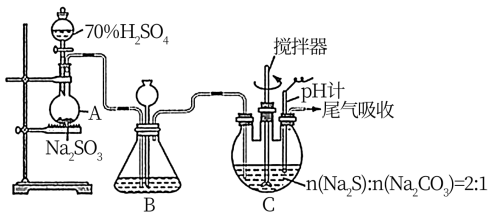
氯亚铂酸钾是合成绝大部分二价铂化合物的原料,广泛应用于电镀、医药中间体、催化剂前驱体等的制备。
已知:
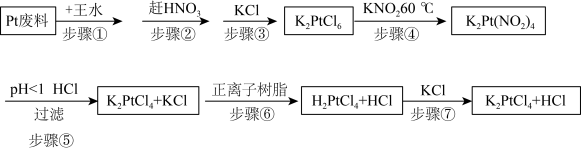
利用Pt废料制备氯亚铂酸钾,流程如下:
(2)关于实验步骤说法错误的是___________。
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目___________ 。
(4)步骤⑦得到的溶液中含 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。
①蒸发浓缩需要控制温度75℃附近的原因___________ 。
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是___________ 。
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是___________ 。___________ 。
已知:
| 氯亚铂酸钾(K2PtCl4) | 水溶性可溶 10 g/L(20℃)、不溶于乙醇、受热分解。 |
| 氯铂酸钾(K2PtCl6) | 溶于热水、微溶于冷水、几乎不溶于乙醇、乙醚。 |
| 氯铂酸(H2PtCl6) | 110℃时部分分解,150℃开始生成金属铂。 |
| 亚硝酸钾(KNO2) | 有一定还原性,还原性:KNO2弱于K2C2O4。 |
| 亚硝酸(HNO2) | 弱酸、不稳定、易分解。 |
| A.步骤①中王水可以用浓硫酸代替 |
| B.步骤②利用硝酸的易挥发性,适合加强热 |
| C.步骤③加入KCl能促进K2PtCl6晶体析出 |
| D.步骤④用还原剂K2C2O4代替更好 |
(2)关于实验步骤说法错误的是___________。
| A.步骤⑤利用酸性条件下亚硝酸的不稳定性 |
| B.步骤⑥用正离子树脂交换是指 |
| C.步骤⑦是氧化还原反应 |
| D.最后得到的溶液中经蒸发能除去HCl |
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目
(4)步骤⑦得到的溶液中含
①蒸发浓缩需要控制温度75℃附近的原因
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是
A.  B.
B.  C.
C.  D.
D.
2024·上海嘉定·二模
类题推荐
葡萄糖酸锌[Zn(C6H11O7)2,相对分子质量 455]是一种有机补锌剂,广泛应用于食药领域。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:

已知:①有关物质在水和乙醇中的溶解性:
②葡萄糖酸锌稍高于 100℃即开始分解。
请回答:
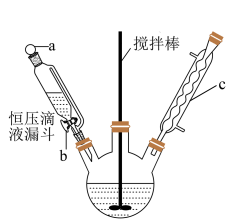
(1)制备葡萄糖酸锌粗品(装置如图,夹持、控温装置略,恒压滴液漏斗中装的是Br2水):
①恒压滴液漏斗需要打开活塞______ (填“a”、“b”或“a 和 b”)。
②装置c的名称______________________ 。
(2)下列有关说法正确的是 。
(3)利用重结晶法可除去葡萄糖酸锌粗品中的硫酸钙杂质,提高产品的质量,选出葡萄糖酸锌重结晶过程中合理的操作并排序_______ (操作步骤可选择,但不可重复使用)。
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入 10mL95%乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在 50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入 10mL 蒸馏水,加热至微沸,加入葡萄糖酸锌粗品,得到葡萄糖酸锌饱和溶液
(4)测定产品纯度:取 mg 提纯后的产品溶于水配制成 100.00mL 溶液,取 25.00mL 置于锥形瓶中,向其中滴入少量 EBT 作为指示剂(遇 Zn2+生成 Zn—EBT),再加入过量的 V1mL c1mol/L EDTA 无色溶液(遇 Zn2+生成 Zn—EDTA),同时发生反应:
Zn—EBT(酒红色) + EDTA = Zn—EDTA(无色) + EBT(蓝色),再用 c2mol/L Zn2+标准溶液滴定至终点,三次滴定平均消耗锌标准溶液 V2mL。
①滴定终点现象为____________________________ 。
②该产品的纯度为_________________________________ (用含 m,c1、c2,V1、V2的代数式表示)。

已知:①有关物质在水和乙醇中的溶解性:
| 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 | |
| 水 | 可溶于冷水,易溶于热水 | 易溶 | 微溶 | |
| 乙醇 | 微溶 | 难溶 | ||

请回答:
(1)制备葡萄糖酸锌粗品(装置如图,夹持、控温装置略,恒压滴液漏斗中装的是Br2水):
①恒压滴液漏斗需要打开活塞
②装置c的名称
(2)下列有关说法正确的是 。
| A.步骤Ⅰ中的 Br2水可以用 KMnO4酸性溶液代替 |
| B.步骤Ⅱ反应完全的现象是不再产生气泡 |
| C.步骤Ⅲ中趁热过滤弃去的滤渣是 CaCO3 |
| D.步骤Ⅳ的一系列操作包括结晶、过滤、洗涤和干燥 |
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入 10mL95%乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在 50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入 10mL 蒸馏水,加热至微沸,加入葡萄糖酸锌粗品,得到葡萄糖酸锌饱和溶液
(4)测定产品纯度:取 mg 提纯后的产品溶于水配制成 100.00mL 溶液,取 25.00mL 置于锥形瓶中,向其中滴入少量 EBT 作为指示剂(遇 Zn2+生成 Zn—EBT),再加入过量的 V1mL c1mol/L EDTA 无色溶液(遇 Zn2+生成 Zn—EDTA),同时发生反应:
Zn—EBT(酒红色) + EDTA = Zn—EDTA(无色) + EBT(蓝色),再用 c2mol/L Zn2+标准溶液滴定至终点,三次滴定平均消耗锌标准溶液 V2mL。
①滴定终点现象为
②该产品的纯度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网