解答题-实验探究题 适中0.65 引用1 组卷30
NaOH溶液可用于中和反应反应热测定和酸碱中和滴定实验中。回答下列问题:
(1)在实验室中进行中和反应反应热测定和中和滴定实验时,一定没有用到的仪器是_____ (填字母,下同)。_____ 。
(3)用标准NaOH溶液滴定未知浓度的盐酸时,下列操作可能会导致所测盐酸的物质的量浓度偏低的是_____。
(4)某实验小组用0.55mol·L-1的NaOH溶液和0.25mol·L-1的H2SO4溶液进行中和反应反应热的测定。取50mLNaOH溶液和50mLH2SO4溶液在_____ (填仪器名称)中进行实验。数据如下:
近似认为50mL0.55mol·L-1NaOH溶液和50mL0.25mol·L-1H2SO4溶液的密度都是1g·mL-1,中和后生成溶液的比热容c=4.18J·g-1·℃-1,则测得中和反应反应热(生成1molH2O) ΔH=_____ kJ・mol-1(精确到小数点后一位)。
(5)常温下,在25.00mL氢氧化钠溶液中逐滴加入0.2000mol·L-1的醋酸溶液,滴定曲线如图所示。_____ mol·L-1。
②若所加入的酸为0.2000mol·L-1的盐酸,则D点时溶液的c(H+)=_____ mol·L-1。
(1)在实验室中进行中和反应反应热测定和中和滴定实验时,一定没有用到的仪器是
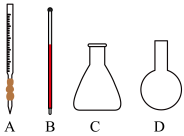
(3)用标准NaOH溶液滴定未知浓度的盐酸时,下列操作可能会导致所测盐酸的物质的量浓度偏低的是_____。
| A.碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液 |
| B.碱式滴定管尖端滴定前无气泡,滴定后有气泡 |
| C.记录消耗的碱液,滴定前平视读数,滴定后仰视读数 |
| D.锥形瓶未用待测盐酸润洗 |
(4)某实验小组用0.55mol·L-1的NaOH溶液和0.25mol·L-1的H2SO4溶液进行中和反应反应热的测定。取50mLNaOH溶液和50mLH2SO4溶液在
| 实验次数 | 起始温度T1/C | 终止温度T2/°C | ||
| H2SO4 | NaOH | 平均值 25.1 26.3 25.3 26.3 | ||
| 1 | 25.2 | 25.0 | 28.5 | |
| 2 | 26.2 | 26.4 | 32.5 | |
| 3 | 25.3 | 25.3 | 28.8 | |
| 4 | 26.1 | 26.5 | 29.6 | |
(5)常温下,在25.00mL氢氧化钠溶液中逐滴加入0.2000mol·L-1的醋酸溶液,滴定曲线如图所示。

②若所加入的酸为0.2000mol·L-1的盐酸,则D点时溶液的c(H+)=
23-24高二上·安徽滁州·阶段练习
类题推荐
I.为测定某盐酸的浓度,用酚酞作指示剂,已知浓度的氢氧化钠溶液滴定
(1)用氢氧化钠标准溶液滴定,直至_______ ,即为滴定终点。
(2)下列操作造成滴定结果偏高的是_______ 。
a.滴定过程中向锥形瓶中加入少量蒸馏水
b.其他操作均正确,滴定终点读数时俯视滴定管的刻度
c.未用氢氧化钠标准溶液润洗碱式滴定管
d.滴定终点读数时发现滴定管尖嘴处悬挂一滴液体
e.未用待测盐酸润洗酸式滴定管
f.滴定前无气泡,滴定后尖嘴部分有气泡
(3)KMnO4常用于氧化还原滴定。滴定时应将KMnO4加入_______ 滴定管中(填“酸式”或“碱式”);在规格为25毫升的滴定管中,若KMnO4溶液起始读数是5.00毫升,此时滴定管中KMnO4的实际体积为_______ 毫升(填标号)。
A.1.5mL B.20mL C.大于20mL D.小于20mL
II. 中和热的测定
(4)某实验小组用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液进行中和热的测定。取50mLNaOH溶液和50 mL H2SO4溶液在_______ 中(填仪器名称)进行实验。数据如表:
近似认为50 mL0.55mol/L NaOH溶液和50 mL0.25mol/L H2SO4溶液的密度都是1g/mL,中和后生成溶液的比热容C=4.18J/(g∙℃),则测得中和热
_______ kJ/mol(精确到小数点后一位)。
(1)用氢氧化钠标准溶液滴定,直至
(2)下列操作造成滴定结果偏高的是
a.滴定过程中向锥形瓶中加入少量蒸馏水
b.其他操作均正确,滴定终点读数时俯视滴定管的刻度
c.未用氢氧化钠标准溶液润洗碱式滴定管
d.滴定终点读数时发现滴定管尖嘴处悬挂一滴液体
e.未用待测盐酸润洗酸式滴定管
f.滴定前无气泡,滴定后尖嘴部分有气泡
(3)KMnO4常用于氧化还原滴定。滴定时应将KMnO4加入
A.1.5mL B.20mL C.大于20mL D.小于20mL
II. 中和热的测定
(4)某实验小组用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液进行中和热的测定。取50mLNaOH溶液和50 mL H2SO4溶液在
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.2 | 25.0 | 25.1 | 28.5 |
| 2 | 26.2 | 26.4 | 26.3 | 32.5 |
| 3 | 25.3 | 25.3 | 25.3 | 28.8 |
| 4 | 26.1 | 26.5 | 26.3 | 29.6 |
I.为测定某盐酸的浓度,用已知浓度的氢氧化钠溶液滴定。
(1)酸式滴定管排气泡的方法是___________ 。
(2)在待测液中滴加几滴酚酞,用氢氧化钠标准溶液滴定,直至___________ ,即为滴定终点。
(3)下列操作造成滴定结果偏高的是___________ 。
a.滴定过程中向锥形瓶中加入少量蒸馏水
b.其他操作均正确,滴定终点读数时俯视滴定管的刻度
c.未用用氢氧化钠标准溶液润洗碱式滴定管
d.滴定终点读数时发现滴定管尖嘴处悬挂一滴液体
e.未用待测盐酸润洗酸式滴定管
f.滴定前无气泡,滴定后尖嘴部分有气泡
(4)KMnO4常用于氧化还原滴定。滴定时应将KMnO4加入___________ 滴定管中(填“酸式”或“碱式”);在规格为25毫升的滴定管中,若KMnO4溶液起始读数是5毫升,此时滴定管中KMnO4的实际体积为___________ 毫升(填标号)。
A.1.5mLB.20mLC.大于20mL D.小于20mL
II. 中和热的测定
(5)某实验小组用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液进行中和热的测定。取50mLNaOH溶液和50 mL H2SO4溶液在______ 中(填仪器名称)进行实验。数据如下:
近似认为50 mL0.55mol/L NaOH溶液和50 mL0.25mol/L H2SO4溶液的密度都是1g/mL,中和后生成溶液的比热容C=4.18J/(g∙℃),则测得中和热
________ kJ/mol(精确到小数点后一位)。
(1)酸式滴定管排气泡的方法是
(2)在待测液中滴加几滴酚酞,用氢氧化钠标准溶液滴定,直至
(3)下列操作造成滴定结果偏高的是
a.滴定过程中向锥形瓶中加入少量蒸馏水
b.其他操作均正确,滴定终点读数时俯视滴定管的刻度
c.未用用氢氧化钠标准溶液润洗碱式滴定管
d.滴定终点读数时发现滴定管尖嘴处悬挂一滴液体
e.未用待测盐酸润洗酸式滴定管
f.滴定前无气泡,滴定后尖嘴部分有气泡
(4)KMnO4常用于氧化还原滴定。滴定时应将KMnO4加入
A.1.5mLB.20mLC.大于20mL D.小于20mL
II. 中和热的测定
(5)某实验小组用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液进行中和热的测定。取50mLNaOH溶液和50 mL H2SO4溶液在
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.2 | 25.0 | 25.1 | 28.5 |
| 2 | 26.2 | 26.4 | 26.3 | 32.5 |
| 3 | 25.3 | 25.3 | 25.3 | 28.8 |
| 4 | 26.1 | 26.5 | 26.3 | 29.6 |
I.某实验小组选用简易量热计,用 盐酸跟
盐酸跟 溶液进行中和反应反应热的测定。试回答下列问题:
溶液进行中和反应反应热的测定。试回答下列问题:
(1)实验中记录的数据如下表:
可近似地认为NaOH溶液和盐酸的密度近似为 ,中和后溶液的比热容
,中和后溶液的比热容 ,则生成
,则生成 时的反应热
时的反应热
_______ (保留小数点后一位)。
(2)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得生成 时的反应热
时的反应热
_______  (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是_______ 。
(3)大量实验测得,25℃和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1molH2O时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应生成1molH2O的热化学方程式:____ 。
II.某化学兴趣小组用 标准溶液滴定食用白醋,测定白醋中醋酸的含量
标准溶液滴定食用白醋,测定白醋中醋酸的含量 。回答下列问题:
。回答下列问题:
(4)取100mL白醋样品溶于水,加水稀释配成1000mL溶液;用图1中_______ (填“A”或“B”)准确量取25.00mL所配白醋溶液放入锥形瓶中,滴加2~3滴酚酞溶液作指示剂。
(5)在碱式滴定管中装入 标准溶液后,要先排出滴定管尖嘴处的气泡,其正确的图示为图2中的
标准溶液后,要先排出滴定管尖嘴处的气泡,其正确的图示为图2中的_______ (填字母)。

(6)下列操作中可能使所测食用白醋的浓度数值偏高的是_______ (填序号)。
①配制标准溶液的固体NaOH中含有KOH杂质
②盛放白醋溶液的锥形瓶用蒸馏水洗净后没有干燥
③碱式滴定管未用 标准溶液润洗,直接注入溶液
标准溶液润洗,直接注入溶液
④碱式滴定管在滴定前尖嘴处没有气泡,滴定后有气泡
⑤读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数
(7)平行滴定3次,平均消耗NaOH溶液的体积15.00mL。则该白醋的总酸量是____ g/100mL。
(1)实验中记录的数据如下表:
| 实验次数 | 起始温度 | 终止温度 |
| 1 | 25.0 | 28.2 |
| 2 | 25.1 | 28.5 |
| 3 | 25.0 | 29.3 |
(2)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得生成
(3)大量实验测得,25℃和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1molH2O时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应生成1molH2O的热化学方程式:
II.某化学兴趣小组用
(4)取100mL白醋样品溶于水,加水稀释配成1000mL溶液;用图1中

(5)在碱式滴定管中装入

(6)下列操作中可能使所测食用白醋的浓度数值偏高的是
①配制标准溶液的固体NaOH中含有KOH杂质
②盛放白醋溶液的锥形瓶用蒸馏水洗净后没有干燥
③碱式滴定管未用
④碱式滴定管在滴定前尖嘴处没有气泡,滴定后有气泡
⑤读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数
(7)平行滴定3次,平均消耗NaOH溶液的体积15.00mL。则该白醋的总酸量是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


