解答题-工业流程题 适中0.65 引用1 组卷0
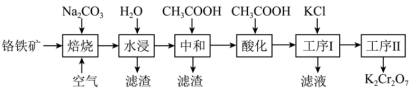
重铬酸钾(K2Cr2O7)在实验室和工业上都有广泛应用,如用于制铬矾、制火柴、电镀、有机合成等。工业上。以铬铁矿[主要成分为Fe(CrO2)2,杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
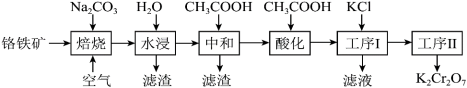
已知:①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4。
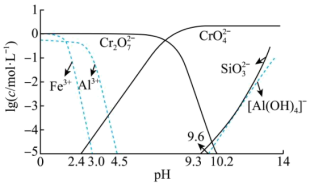
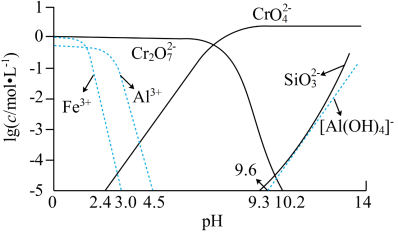
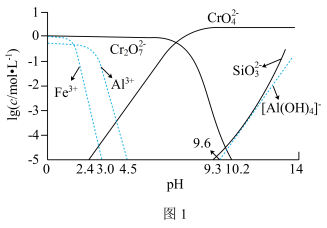
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图1所示。当溶液中可溶性组分浓度c≤10-5 mol·L-1时,可认为已除尽。
③有关物质的溶解度如图2所示。

回答下列问题:
(1)写出焙烧过程中发生的主要反应的化学方程式___________ 。
(2)水浸滤渣的主要成分是Fe(OH)3,写出生成此滤渣的化学方程式___________ 。
(3)中和步骤中理论pH的范围是___________ ,中和后滤渣的主要成分是___________ (填化学式)。
(4)酸化时加冰醋酸,简述不能用盐酸的可能原因是___________ 。
(5)工序1加入KCl后发生反应的离子方程式为___________ 。滤液经___________ (填操作名称)也可得到部分K2Cr2O7固体。经过工序2可得到更纯的K2Cr2O7固体,则工序2方法为___________ 。

已知:①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4。
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图1所示。当溶液中可溶性组分浓度c≤10-5 mol·L-1时,可认为已除尽。
③有关物质的溶解度如图2所示。


回答下列问题:
(1)写出焙烧过程中发生的主要反应的化学方程式
(2)水浸滤渣的主要成分是Fe(OH)3,写出生成此滤渣的化学方程式
(3)中和步骤中理论pH的范围是
(4)酸化时加冰醋酸,简述不能用盐酸的可能原因是
(5)工序1加入KCl后发生反应的离子方程式为
2024·四川成都·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网