解答题-原理综合题 较难0.4 引用1 组卷135
CO2的强温室效应导致全球气候显著变化,此变化引起各国政府的高度重视。利用CO2是实现碳中和目标的重要技术手段。我国某教授团队报道了一种以棒状CeO2为载体,通过引入Ti调控催化剂,实现在反应釜中CO2加氢反应一步制乙醇的技术,反应原理为 。
。
(1)某些常见化学键的键能数据如下表:
依据表中数据计算 的
的 H=
H=_______  ,下列有利于该反应自发进行的条件是
,下列有利于该反应自发进行的条件是_______ (填标号)。
A.高温 B.低温 C.任何温度
(2)在催化剂作用下, 加氢反应制乙醇的反应历程如图(部分吸附态的物质未列出)。
加氢反应制乙醇的反应历程如图(部分吸附态的物质未列出)。
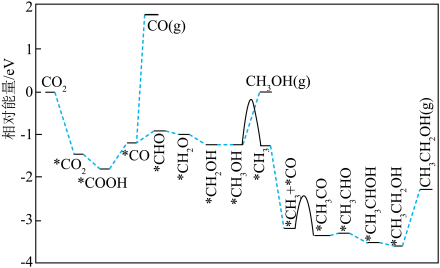
该反应中形成的化学键有_______ (填标号)。
A.σ键 B.非极性键 C.氢键
(3)一定温度下,在恒容密闭容器中充入一定量 与
与 进行反应,下列条件能判断该反,应达到平衡状态的是
进行反应,下列条件能判断该反,应达到平衡状态的是_______ (填标号)。
a. b.容器中气体的平均摩尔质量不变
b.容器中气体的平均摩尔质量不变
c.CH3CH2OH的百分含量保持不变 d.容器中混合气体的密度保持不变
(4)分别按投料比L=1∶4、1∶2、4∶1[ ]将反应物投入密闭容器中,在恒定压强为
]将反应物投入密闭容器中,在恒定压强为 MPa下进行反应,测得
MPa下进行反应,测得 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。
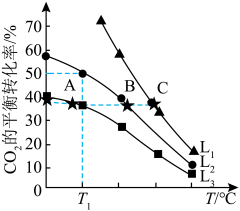
①表示 的曲线为
的曲线为_______ (填标号)。
② 、
、 、
、 由大到小的顺序是
由大到小的顺序是_______ 。
③ ℃、投料比为
℃、投料比为 下,该反应的平衡常数
下,该反应的平衡常数
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)某些常见化学键的键能数据如下表:
| 化学键 | C=O | H—O | H—H | C—O | C—H | C—C |
| 键能( | 803 | 463 | 436 | 326 | 414 | 348 |
A.高温 B.低温 C.任何温度
(2)在催化剂作用下,

该反应中形成的化学键有
A.σ键 B.非极性键 C.氢键
(3)一定温度下,在恒容密闭容器中充入一定量
a.
c.CH3CH2OH的百分含量保持不变 d.容器中混合气体的密度保持不变
(4)分别按投料比L=1∶4、1∶2、4∶1[

①表示
②
③
2024·贵州黔东南·二模
类题推荐
以 催化加氢制
催化加氢制 有利于实现“碳中和”。合成时有反应:
有利于实现“碳中和”。合成时有反应:
反应Ⅰ(主反应):

反应Ⅱ(副反应):

相关键能如下表:
回答下列问题:
(1)
_______
(2)向某密闭容器中按投料比 通入混合气体,体系压强恒定为2.5MPa,控制不同温度若只发生反应Ⅰ(主反应)达平衡,体系中
通入混合气体,体系压强恒定为2.5MPa,控制不同温度若只发生反应Ⅰ(主反应)达平衡,体系中 和
和 的体积分数如图1所示。
的体积分数如图1所示。

①反应Ⅰ(主反应)在_______ (填“高温”、“低温”、“任何温度”)下自发进行。
② 温度下,下列有关反应Ⅰ(主反应)说法正确的是
温度下,下列有关反应Ⅰ(主反应)说法正确的是_______
A.若 时,反应达平衡
时,反应达平衡
B.若反应混合气体的密度保持不变,反应达平衡
C.若 保持不变时,反应达平衡
保持不变时,反应达平衡
D.反应达平衡时,不再有 和
和 生成
生成
反应Ⅰ(主反应)反应10min达A点平衡状态,则该反应的分压平衡常数
_______ (结果保留2位小数,以平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 的平衡转化率或平衡时
的平衡转化率或平衡时 的选择性随温度的变化如图2。
的选择性随温度的变化如图2。
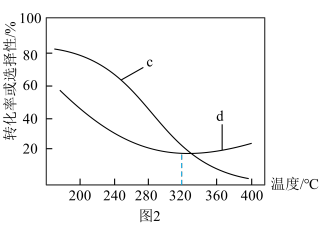
已知: 的选择性=
的选择性=
①图2中曲线c、d表示 选择性的曲线是
选择性的曲线是_______ (填“c”、“d”),理由是_______ 。
②若不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有______ (写一条)
反应Ⅰ(主反应):
反应Ⅱ(副反应):
相关键能如下表:
化学键 | H—H | C=O | C≡O | O—H |
键能 | 436 | 803 | 1071 | 464 |
(1)
(2)向某密闭容器中按投料比

①反应Ⅰ(主反应)在
②
A.若
B.若反应混合气体的密度保持不变,反应达平衡
C.若
D.反应达平衡时,不再有
反应Ⅰ(主反应)反应10min达A点平衡状态,则该反应的分压平衡常数
(3)在恒压、

已知:
①图2中曲线c、d表示
②若不改变反应时间和温度,一定能提高
HCOOH是一种重要的化工原料。
(1)已知几种共价键的键能如下表。
根据上述键能估算:

___________  。
。
(2)HCOOH是一种储氢材料,其某种制备原理如图所示。反应1断裂的化学键有___________ (填标号)。
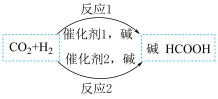
A.极性键 B.氢键 C.非极性键
(3) 的速率公式为
的速率公式为 (k为速率常数,只与温度、催化剂有关)。已知经验公式为
(k为速率常数,只与温度、催化剂有关)。已知经验公式为 (其中,
(其中, 、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得
、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得 与温度(
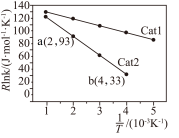
与温度( )的关系如图所示。其他条件都相同时,催化效率较高的是
)的关系如图所示。其他条件都相同时,催化效率较高的是___________ (填“Cat1”或“Cat2”)。Cat2催化剂作用下,活化能 为
为___________  。
。
(4)在一定温度下,保持总压强为170kPa.在 为1:1、1:2、1:3条件下发生反应
为1:1、1:2、1:3条件下发生反应 ,测得
,测得 的平衡转化率与
的平衡转化率与 之间的关系如图所示。
之间的关系如图所示。
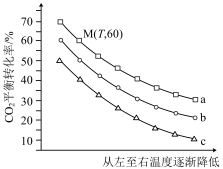
①下列条件能判断该反应达到平衡状态的是___________ (填标号)。
a. 的生成速率与
的生成速率与 的消耗速率相等
的消耗速率相等
b.容器中混合气体的密度保持不变
c.容器中气体的平均摩尔质量不变
d. 的百分含量保持不变
的百分含量保持不变
②曲线c代表的投料比为___________ 。M点条件下,平衡常数 为
为___________  。(提示:用分压计算的平衡常数为
。(提示:用分压计算的平衡常数为 ,分压=总压×物质的量分数)
,分压=总压×物质的量分数)
(1)已知几种共价键的键能如下表。
| 共价键 | ||||||
| 键能 | 803 | 436 | 413 | 745 | 351 | 463 |
(2)HCOOH是一种储氢材料,其某种制备原理如图所示。反应1断裂的化学键有

A.极性键 B.氢键 C.非极性键
(3)

(4)在一定温度下,保持总压强为170kPa.在

①下列条件能判断该反应达到平衡状态的是
a.
b.容器中混合气体的密度保持不变
c.容器中气体的平均摩尔质量不变
d.
②曲线c代表的投料比为
对CH4和CO2的高效利用能够有效缓解全球变暖。
(1)在两个体积均为1L的恒容密闭容器中,在相同温度下进行反应CH4(g)+CO2(g) 2CO(g)+2H2(g)(不发生其他反应),起始时按表中相应的量加入物质。CO2的平衡转化率如表所示。
2CO(g)+2H2(g)(不发生其他反应),起始时按表中相应的量加入物质。CO2的平衡转化率如表所示。
①该温度下,反应的平衡常数K=___________ 。
②下列条件能说明反应达到平衡状态的是___________ (填标号)。
A.v正(CH4)=2v逆(CO)
B.容器内混合气体的总压强不再变化
C.容器内混合气体的密度保持不变
D.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
③达到平衡时,容器Y内CO2的平衡转化率___________ 50%。(填“>”,“<”或“=”)
(2)CO2还可以通过催化加氢合成乙醇:6H2(g)+2CO2(g) C2H5OH(g)+3H2O(g) ΔH<0,设m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) ΔH<0,设m为起始时的投料比,即m= 。通过实验得到下列图像:
。通过实验得到下列图像:
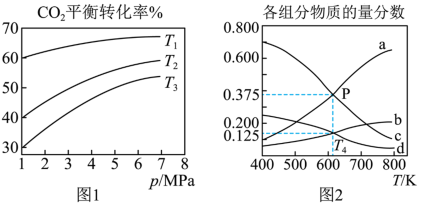
①若图1中m相同,则温度从高到低排序为___________ 。
②图2表示在m=3时,平衡状态各物质的物质的量分数与温度的关系,则d曲线表示的是___________ 的物质的量分数。在T4温度、总压为5MPa的恒压条件下,该反应压强平衡常数Kp的计算式(代入数据,不用化简)为___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),CO2的平衡转化率为___________ (保留3位有效数字)。
(1)在两个体积均为1L的恒容密闭容器中,在相同温度下进行反应CH4(g)+CO2(g)
| 容器 | 起始物质的量/mol | CO2的平衡转化率 | |||
| CH4 | CO2 | CO | H2 | ||
| X | 1 | 1 | 0 | 0 | 50% |
| Y | 2 | 2 | 0 | 0 | — |
②下列条件能说明反应达到平衡状态的是
A.v正(CH4)=2v逆(CO)
B.容器内混合气体的总压强不再变化
C.容器内混合气体的密度保持不变
D.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
③达到平衡时,容器Y内CO2的平衡转化率
(2)CO2还可以通过催化加氢合成乙醇:6H2(g)+2CO2(g)

①若图1中m相同,则温度从高到低排序为
②图2表示在m=3时,平衡状态各物质的物质的量分数与温度的关系,则d曲线表示的是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


