解答题-原理综合题 较难0.4 引用1 组卷150
Ⅰ.生产、生活废水必须要做及时处理,否则会影响人类的生活环境。废水的常见化学处理法有:中和法、氧化还原法、萃取法、吸附法、混凝法、沉淀法等。
(1)下列物质常被用于污水处理,其中属于纯净物的是___________
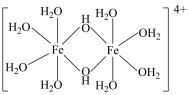
(2)三价铁的强酸盐溶液因会发生水解,可被用作净水剂,其水解时会产生黄色的[Fe(OH)(H2O)5]2+以及二聚体[Fe2 (OH)2(H2O)8]4+ (结构如图)。则二聚体中Fe的配位数为___________ 。
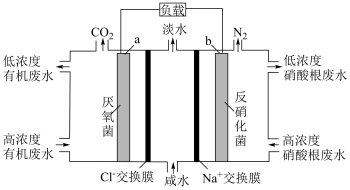
(3)某工厂的酸性 废水中同时含有高浓度有机物(化学式为C6H10O5)和NO 离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
Ⅱ.大量含氮污水任意排放将造成藻类疯长,出现水体富营养化等问题。某小组尝试用NaClO溶液处理含氨氮废水。
(4)室温下,部分酸的电离平衡常数如表所示,
下列关于次氯酸钠溶液的说法中,错误的是___________;
(5)下列物质中不能与NaClO反应的是___________
(6)NaClO将废水中的NH3氧化为无污染气体,反应的化学方程式为___________ ;实际实验中NaClO溶液的投入量要大于理论计算量,可能的原因是___________ 。
Ⅲ.含铜(Cu2+)废水是冶金、电子等行业产生的废水,直接排放会导致严重污染。工业上常用NaHS作为沉淀剂处理Cu2+离子。
(7)已知0.1 mol·L−1NaHS溶液呈碱性;
①若将该溶液中的离子按浓度由大到小进行排序,排位第三的离子是___________
A.Na+ B.HS− C.S2− D.OH−
②通过计算,说明溶液呈碱性的原因:___________
(8)沉淀铜离子时,发生反应Cu2+(aq) + 2HS− (aq) CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =
CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =___________ (用该反应的K,H2S的Ka1和Ka2表示)。
(1)下列物质常被用于污水处理,其中属于纯净物的是___________
| A.漂粉精 | B.聚丙烯酸钠 | C.明矾 | D.石灰乳 |
(2)三价铁的强酸盐溶液因会发生水解,可被用作净水剂,其水解时会产生黄色的[Fe(OH)(H2O)5]2+以及二聚体[Fe2 (OH)2(H2O)8]4+ (结构如图)。则二聚体中Fe的配位数为

(3)某工厂的

| A.图中的a极为阳极,发生氧化反应 |
| B.该装置工作时,电子经导线由a极流向b极 |
| C.Na+向b极流动,故b极为负极 |
| D.该装置亦可用于咸水淡化 |
Ⅱ.大量含氮污水任意排放将造成藻类疯长,出现水体富营养化等问题。某小组尝试用NaClO溶液处理含氨氮废水。
(4)室温下,部分酸的电离平衡常数如表所示,
| 化学式 | 常温下的电离平衡常数 |
| HClO | Ka = 3×10−8 |
| H2CO3 | Ka1 = 4.2×10−7 Ka2 = 4.8×10−11 |
| H2S | Ka1 = 1.3×10−7 Ka2 = 7.1×10−15 |
| A.依据物料守恒关系,[Na+] =[ClO−] + [HClO] |
| B.依据强酸制弱酸原理,通入少量SO2有利于HClO生成,可增强漂白作用 |
| C.由于NaClO水解呈碱性,则[Na+]>[ClO−] |
| D.根据“有弱才水解”规律,所以NaClO是弱电解质 |
(5)下列物质中不能与NaClO反应的是___________
| A.CO2 | B.NaHCO3 | C.H2S | D.NaHS |
(6)NaClO将废水中的NH3氧化为无污染气体,反应的化学方程式为
Ⅲ.含铜(Cu2+)废水是冶金、电子等行业产生的废水,直接排放会导致严重污染。工业上常用NaHS作为沉淀剂处理Cu2+离子。
(7)已知0.1 mol·L−1NaHS溶液呈碱性;
①若将该溶液中的离子按浓度由大到小进行排序,排位第三的离子是
A.Na+ B.HS− C.S2− D.OH−
②通过计算,说明溶液呈碱性的原因:
(8)沉淀铜离子时,发生反应Cu2+(aq) + 2HS− (aq)
2024·上海普陀·二模
类题推荐
某校同学在完成铜与硝酸的分组实验后,产生大量含有H+、Cu2+等离子的废液,为了测定Cu2+的浓度并对废液进行处理,进行如下实验。
I 测定废液中铜离子含量
原理:2Cu2++4I−=2CuI↓+I2,I2+ =2I−+
=2I−+
步骤:①取10.00 mL废液样品,加入一定量的硫酸并煮沸。
②加入氨水调节溶液的pH=3.2 ~ 4.0,再加入过量的KI,将溶液定容为100 mL。
③取步骤②中定容后的溶液20.00 mL,淀粉作指示剂,用0.0500 mol·L−1 Na2S2O3溶液滴定,多次滴定,平均消耗Na2S2O3溶液的体积为16.00 mL。
(1)步骤①加入一定量的硫酸并煮沸的目的是_______ 。
(2)步骤②中溶液的pH<3.2,可能会导致测定的铜离子浓度_______ 。
A.偏高 B. 偏低 C. 无影响
判断依据_______ 。
(3)步骤③中所取的20.00 mL溶液应加入到
(4)计算原废液中c(Cu2+)=_______ mol·L−1。
Ⅱ中和沉淀法处理
已知:①该区域含铜废液的排放标准为Cu2+的浓度不超过0.01 mg·L−1
②常温下,Ksp[Cu(OH)2]=2.2×10−20
(5)常温下,若向废液样品中加入石灰乳至中性,判断处理后的废液能否达到排放标准______ 。(写出计算过程)
(6)向废液样品中滴加氨水,调节溶液的pH,铜去除率与溶液pH的关系,如图所示。解释pH由7到10时,铜去除率下降的主要原因_______ 。
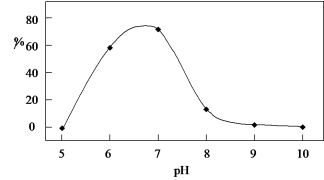
Ⅲ硫化物沉淀法处理
已知:常温下Ka1(H2S)=1.3×10−7、Ka2(H2S)=7.0×10−15、Ksp(CuS)=6.4×10−36
(7)常温下,调节Na2S溶液的pH=7,比较溶液中含硫微粒浓度的大小_______ 。
(8)常温Ksp(FeS)=6.3×10−18,下列说法正确的是
Ⅳ溶剂萃取法
用萃取剂RH(一种有机酸)可萃取废液中的Cu2+,有机层能形成较高浓度的含铜配合物,向分离出的有机层中加入20%的H2SO4溶液进行反萃取,可以回收铜。
(9)实验室进行萃取操作时,需对分液漏斗放气,正确放气的图示为
(10)用RH萃取时,适度增大溶液的pH,Cu2+萃取率会升高的原因是_______ 。
I 测定废液中铜离子含量
原理:2Cu2++4I−=2CuI↓+I2,I2+
步骤:①取10.00 mL废液样品,加入一定量的硫酸并煮沸。
②加入氨水调节溶液的pH=3.2 ~ 4.0,再加入过量的KI,将溶液定容为100 mL。
③取步骤②中定容后的溶液20.00 mL,淀粉作指示剂,用0.0500 mol·L−1 Na2S2O3溶液滴定,多次滴定,平均消耗Na2S2O3溶液的体积为16.00 mL。
(1)步骤①加入一定量的硫酸并煮沸的目的是
(2)步骤②中溶液的pH<3.2,可能会导致测定的铜离子浓度
A.偏高 B. 偏低 C. 无影响
判断依据
(3)步骤③中所取的20.00 mL溶液应加入到
| A.滴定管 | B.烧杯 | C.锥形瓶 | D.容量瓶 |
(4)计算原废液中c(Cu2+)=
Ⅱ中和沉淀法处理
已知:①该区域含铜废液的排放标准为Cu2+的浓度不超过0.01 mg·L−1
②常温下,Ksp[Cu(OH)2]=2.2×10−20
(5)常温下,若向废液样品中加入石灰乳至中性,判断处理后的废液能否达到排放标准
(6)向废液样品中滴加氨水,调节溶液的pH,铜去除率与溶液pH的关系,如图所示。解释pH由7到10时,铜去除率下降的主要原因
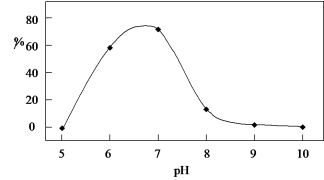
Ⅲ硫化物沉淀法处理
已知:常温下Ka1(H2S)=1.3×10−7、Ka2(H2S)=7.0×10−15、Ksp(CuS)=6.4×10−36
(7)常温下,调节Na2S溶液的pH=7,比较溶液中含硫微粒浓度的大小
(8)常温Ksp(FeS)=6.3×10−18,下列说法正确的是
| A.常温下,CuS的溶解度大于FeS |
| B.反应Cu2++H2S=CuS↓+2H+不能发生 |
| C.除去废液中的Cu2+,可选用FeS作沉淀剂 |
| D.常温下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)减小 |
Ⅳ溶剂萃取法
用萃取剂RH(一种有机酸)可萃取废液中的Cu2+,有机层能形成较高浓度的含铜配合物,向分离出的有机层中加入20%的H2SO4溶液进行反萃取,可以回收铜。
(9)实验室进行萃取操作时,需对分液漏斗放气,正确放气的图示为
A. | B. | C. | D. |
(10)用RH萃取时,适度增大溶液的pH,Cu2+萃取率会升高的原因是
Ⅰ.石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素的主要化合价是-2价),对设备、环境等造成严重危害。已知:常温下H2S溶解度为1∶2.6(体积)。下图为常温下H2S、HS-、S2-在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:
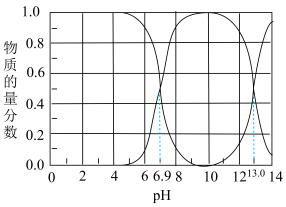
(1)由图判断,H2S的一级电离平衡常数为Ka1=___________ 。
(2)25℃,HS-电离程度小于水解程度,依据是:___________ 。
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是___________ 。
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:___________ 。
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是___________ 。
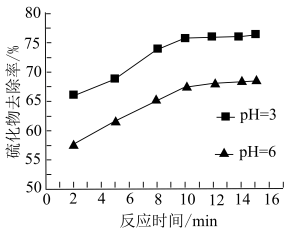
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:___________ 。
(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________
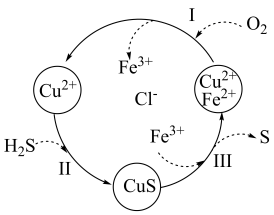
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。
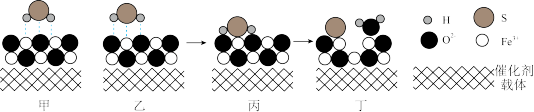
Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因___________ 。

(1)由图判断,H2S的一级电离平衡常数为Ka1=
(2)25℃,HS-电离程度小于水解程度,依据是:
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:

(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________

| A.转化过程中参与循环的离子只有Fe2+ |
| B.转化过程有四种元素的化合价发生了变化 |
| C.过程Ⅲ中发生的反应为CuS+2Fe3+=S+2Fe2++Cu2+ |
| D.氧化性由强到弱的顺序:O2 >Fe3+> S |
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。

Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因
硫化氢(H2S)、二氧化硫(SO2)是有害气体,可用多种方法进行脱除。
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:H2S(aq)+Cu2+ CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为
CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为___________ 。 (已知25℃时Ksp (CuS) =1.25×10−36,Ka1 (H2S) =10−7,Ka2 (H2S ) =10−12)
(2)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应: 、
、 。
。
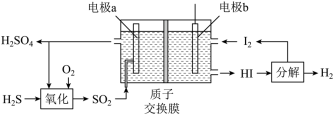
①电极a上发生反应的电极反应式为___________ 。
②理论上1 mol H2S参加反应可产生H2的物质的量为___________ 。
(3)硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+H2O+SO2=2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是______ (填化学式)
②将浓度均为0.1 mol·L-1的NaHSO3和Na2SO3等体积混合,溶液pH=7.2,分析该溶液中c(HSO )
) _______ c(SO ) (填“>”,“>”或“=”)。
) (填“>”,“>”或“=”)。
③SO2也可用石灰乳吸收,得到的CaSO3浆料可用于制备NaHSO3溶液。写出用CaSO3浆料制备NaHSO3溶液实验方案:____ 。
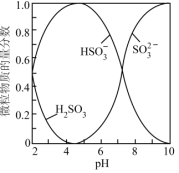
已知:室温下,溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的分布如下图所示。
的物质的量分数随pH的分布如下图所示。
实验中可选用的试剂:

(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:H2S(aq)+Cu2+
(2)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:

①电极a上发生反应的电极反应式为
②理论上1 mol H2S参加反应可产生H2的物质的量为
(3)硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+H2O+SO2=2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=4.0×10−8 | Ka1=4.3×10−7,Ka2=4.7×10−11 | Ka1=1.5×10−3,Ka2=6×10−8 |
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是
②将浓度均为0.1 mol·L-1的NaHSO3和Na2SO3等体积混合,溶液pH=7.2,分析该溶液中c(HSO
③SO2也可用石灰乳吸收,得到的CaSO3浆料可用于制备NaHSO3溶液。写出用CaSO3浆料制备NaHSO3溶液实验方案:
已知:室温下,溶液中H2SO3、HSO

实验中可选用的试剂:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


