填空题 适中0.65 引用1 组卷32
室温下,用0.1000mol·L−1NaOH滴定20.00mL0.1000mol·L−1HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如下图所示。
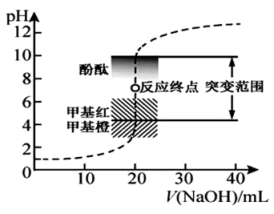
(1)酸碱式滴定管在加溶液滴定前,需要的操作是___________ 和___________ 。
(2)配制上述NaOH标准溶液时,下列仪器中不必要 用到的有___________ 。(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(3)当V(NaOH)=20.00mL时,溶液中所有离子的浓度存在的关系是___________ 。
(4)已知lg5=0.7.当加入的V(NaOH)=30.00mL时,溶液中pH=___________ 。
(5)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+和CrO 反应生成砖红色沉淀表示滴定终点。当溶液中的Cl-恰好完全沉淀时,溶液中的c(Ag+)=
反应生成砖红色沉淀表示滴定终点。当溶液中的Cl-恰好完全沉淀时,溶液中的c(Ag+)=___________ mol/L;c(CrO )=
)=___________ mol/L;
已知:①25℃时,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=1.8×10-10;

(1)酸碱式滴定管在加溶液滴定前,需要的操作是
(2)配制上述NaOH标准溶液时,下列仪器中
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(3)当V(NaOH)=20.00mL时,溶液中所有离子的浓度存在的关系是
(4)已知lg5=0.7.当加入的V(NaOH)=30.00mL时,溶液中pH=
(5)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+和CrO
已知:①25℃时,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=1.8×10-10;
②当溶液中某种离子的浓度等于或小于1.0×10-5mol/L时,可认为已完全沉淀。
23-24高二上·浙江杭州·阶段练习
类题推荐
室温下,用0.1000 mol⋅L NaOH溶液滴定20.00 mL 0.1000 mol⋅L
NaOH溶液滴定20.00 mL 0.1000 mol⋅L HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如图所示:
HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如图所示:
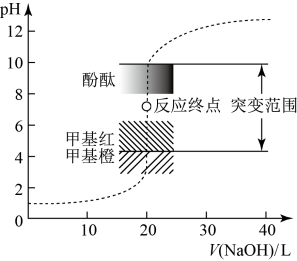
(1)滴定管在加溶液滴定前,需要进行的操作是____________ 和____________ 。
当 mL时,溶液中所有离子的浓度存在的关系是
mL时,溶液中所有离子的浓度存在的关系是____________ 。
(2)已知 。当加入的
。当加入的 mL时,溶液中
mL时,溶液中
_____
(3)下列说法不正确 的是___
(4)在化学分析中,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 和
和 反应生成砖红色沉淀表示滴定终点。当溶液中的
反应生成砖红色沉淀表示滴定终点。当溶液中的 恰好完全沉淀时,溶液中的
恰好完全沉淀时,溶液中的
______ mol/L;
______ mol/L。
已知:①25℃时, ,
,
②当溶液中某种离子的浓度等于或小于 mol/L时,可认为已完全沉淀。
mol/L时,可认为已完全沉淀。

(1)滴定管在加溶液滴定前,需要进行的操作是
当
(2)已知
(3)下列说法
| A.NaOH与盐酸恰好完全反应时, |
| B.选择甲基红指示反应终点,误差比甲基橙的大 |
| C.当接近滴定终点时,极少量的碱就会引起溶液的pH突变 |
| D.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
已知:①25℃时,
②当溶液中某种离子的浓度等于或小于
25℃时,部分物质的电离平衡常数如表所示:
(1) 25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,三种溶液的pH由大到小的顺序为 _______________
(2)工业上可用氨水除去尾气SO2。将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的 =
=___________
(3)常温下,用0.1000mol/L溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图:
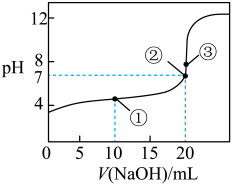
①在滴定的实验过程中,不需要的仪器或用品是________ (填序号)
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
②到达滴定终点的标志是:___________________________
③下列操作会导致测定结果偏高的是_________________
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
④如图点①所示溶液中c(CH3COO-)+c(OH-)__________ c(CH3COOH)+c(H+)(填“ ”“
”“ ”或“
”或“ ”,下同);点②所示溶液(pH=7)c(Na+)
”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______ mol/L,此时溶液中c(CrO42-)等于_________ mol/L(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
| 化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10-2;Ka2=6.2×10-8 |
(2)工业上可用氨水除去尾气SO2。将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的
(3)常温下,用0.1000mol/L溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图:

①在滴定的实验过程中,不需要的仪器或用品是
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
②到达滴定终点的标志是:
③下列操作会导致测定结果偏高的是
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
④如图点①所示溶液中c(CH3COO-)+c(OH-)
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为
回答下列问题:
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)_________________________ 。实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的__________ 中,然后再用蒸馏水稀释到所需要的浓度,是为了抑制其水解。
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl ②CH3COOH ③Ba(OH)2 ④ Na2CO3 ⑤ KCl ⑥NH4Cl,溶液的pH由小到大的顺序为________ (填序号)[已知Kb(NH3·H2O)=1.8×10-5,Ka(CH3COOH)=1.75×10-5]。
(3)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(25℃):
①25 ℃时,等物质的量浓度的3种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,其pH由大到小的顺序为________________ (填序号)。
②25 ℃时,向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________ 。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中的Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为__________ mol·L−1,此时溶液中c(CrO42−)为_________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl ②CH3COOH ③Ba(OH)2 ④ Na2CO3 ⑤ KCl ⑥NH4Cl,溶液的pH由小到大的顺序为
(3)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(25℃):
| 化学式 | HCN | CH3COOH | H2CO3 |
| 电离平衡常数 | K=4.9×10−10 | K=1.8×10−5 | K1=4.4×10−7 K2=4.7×10−11 |
①25 ℃时,等物质的量浓度的3种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,其pH由大到小的顺序为
②25 ℃时,向NaCN溶液中通入少量的CO2,发生反应的离子方程式为
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中的Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


