解答题-实验探究题 较难0.4 引用2 组卷515
12-钨磷酸( ,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:
,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:
【制备步骤】
Ⅰ.12-钨磷酸钠( )溶液的制备
)溶液的制备
取 (分子量:330)和
(分子量:330)和 (分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。
(分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。
Ⅱ.12-钨磷酸的制备
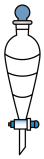
将烧杯中液体一并转移至分液漏斗中,加入205 mL乙醚及6 mL 6 mol/L的盐酸(均过量),振荡后静置,液体分三层,分出最下层液体于仪器 X 中,在通风橱内,置于热水浴中加热蒸除少量乙醚,得白色12-钨磷酸固体8.64 g。
(1)请用离子方程式表示步骤Ⅰ中12-钨磷酸钠的制备原理___________ ;
(2)“仪器X”为___________ ;
(3)步骤Ⅱ中,振荡分液漏斗制备12-钨磷酸时,需不时拧开分液漏斗活塞进行放气,这样操作的目的是___________ ;
(4)步骤Ⅱ中“液体分为三层”,最上层液体的主要成分为___________ (填代号);
a.乙醚 b.12-钨磷酸钠溶液 c.水 d.NaCl溶液
(5)步骤Ⅱ蒸除乙醚时,采用水浴加热而不采用明火加热的目的是___________ ;
(6)制备出的12-钨磷酸常因有灰尘、纸屑等有机纤维杂质落入而形成蓝色的“杂多蓝”,出现这一现象时,加入适量过氧化氢或溴水可使其恢复。上述实验现象可体现出12-钨磷酸常温下具有较强的___________ (填“氧化性”或“还原性”);
(7)根据上述实验数据计算,该实验的产率为___________ (设所得白色固体均为无水12-钨磷酸,结果保留两位有效数字);
(8)通过对X-射线衍射结果分析,得到12-钨磷酸根离子结构如下图,请回答:___________ ;
②12-钨磷酸根离子中存在___________ 种处于不同化学环境的氧原子。
| 物质 | 性质 |
| 乙醚 | 无色液体,密度比水小且难溶于水,沸点34.5℃ |
| 12-钨磷酸 | 白色固体,能溶于水,常温下极易与乙醚形成密度大于水且难溶于水的油状醚合物 |
Ⅰ.12-钨磷酸钠(
取
Ⅱ.12-钨磷酸的制备
将烧杯中液体一并转移至分液漏斗中,加入205 mL乙醚及6 mL 6 mol/L的盐酸(均过量),振荡后静置,液体分三层,分出最下层液体于
(1)请用离子方程式表示步骤Ⅰ中12-钨磷酸钠的制备原理
(2)“仪器X”为
(3)步骤Ⅱ中,振荡分液漏斗制备12-钨磷酸时,需不时拧开分液漏斗活塞进行放气,这样操作的目的是
(4)步骤Ⅱ中“液体分为三层”,最上层液体的主要成分为
a.乙醚 b.12-钨磷酸钠溶液 c.水 d.NaCl溶液
(5)步骤Ⅱ蒸除乙醚时,采用水浴加热而不采用明火加热的目的是
(6)制备出的12-钨磷酸常因有灰尘、纸屑等有机纤维杂质落入而形成蓝色的“杂多蓝”,出现这一现象时,加入适量过氧化氢或溴水可使其恢复。上述实验现象可体现出12-钨磷酸常温下具有较强的
(7)根据上述实验数据计算,该实验的产率为
(8)通过对X-射线衍射结果分析,得到12-钨磷酸根离子结构如下图,请回答:
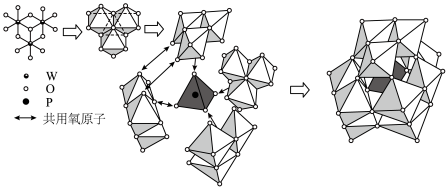
②12-钨磷酸根离子中存在
2024·辽宁鞍山·二模
类题推荐
实验室用苯和乙酸酐在氯化铝的催化作用下制备苯乙酮,反应方程式为:

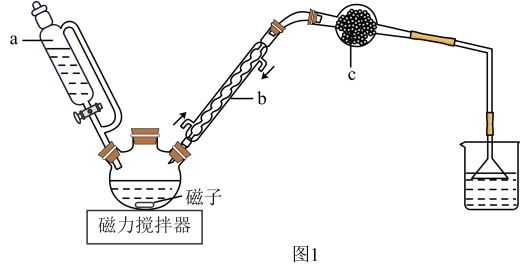
制备过程中还有CH3COOH + AlCl3→ CH3COOAlCl2+ HCl↑等副反应。制备实验装置如图1,实验步骤如下:
I.制备苯乙酮:
在三颈瓶中加入20g无水AlCl3和30 mL无水苯(26.4g约0.338mol)。不断搅拌的条件下通过a装置慢慢滴加6 mL乙酸酐(6. 5g约0.064mol)和10 mL无水苯的混合液,控制滴加速率,滴加完毕约需要20分钟。滴加完毕后使反应液缓缓加热回流1小时。
II.分离与提纯:
①将冷却后的三颈瓶置于冰水浴中,边搅拌边慢慢滴加一定量盐浓酸与冰水混合液,待瓶内固体全溶后移入分液漏斗中,静置分层,分液除去水层,得到有机层。
②水层用苯萃取两次,每次用苯15mL,将两次分液得到的有机层与①的有机层合并。
③将合并后有机层依次用10% 氢氧化钠、15mL水洗涤,分液,弃去无机层,再用无水MgSO4干燥,得到苯乙酮粗产品。
④将苯乙酮粗产品放入蒸馏烧瓶中,,先在水浴上蒸馏回收苯,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管,蒸馏收集198 -202°C馏分,产品质量约为5.0g。
主要反应试剂及产物的物理常数
回答下列问题:
(1)仪器a的名称是_______ ;装置b的作用是_______ 。
(2)合成过程中要保证无水的操作环境,其理由是_______ 。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致_______ (填标号)。
(4)本实验所加苯是严重过量的,苯除了作反应物和提高乙酸酐转化率的作用外,你认为还起到的作用是_______ ;分离和提纯操作②的目的是_______ 。
(5)分离提纯步骤④中蒸馏收集苯乙酮产品时,改用空气冷凝管的原因是_______ ;步骤④操作也可以选择图2的装置进行减压蒸馏,其中毛细管的作用是 _______ ,该实验所得产品的实际产率是_______ 。(计算结果保留三位有效数字)


制备过程中还有CH3COOH + AlCl3→ CH3COOAlCl2+ HCl↑等副反应。制备实验装置如图1,实验步骤如下:

I.制备苯乙酮:
在三颈瓶中加入20g无水AlCl3和30 mL无水苯(26.4g约0.338mol)。不断搅拌的条件下通过a装置慢慢滴加6 mL乙酸酐(6. 5g约0.064mol)和10 mL无水苯的混合液,控制滴加速率,滴加完毕约需要20分钟。滴加完毕后使反应液缓缓加热回流1小时。
II.分离与提纯:
①将冷却后的三颈瓶置于冰水浴中,边搅拌边慢慢滴加一定量盐浓酸与冰水混合液,待瓶内固体全溶后移入分液漏斗中,静置分层,分液除去水层,得到有机层。
②水层用苯萃取两次,每次用苯15mL,将两次分液得到的有机层与①的有机层合并。
③将合并后有机层依次用10% 氢氧化钠、15mL水洗涤,分液,弃去无机层,再用无水MgSO4干燥,得到苯乙酮粗产品。
④将苯乙酮粗产品放入蒸馏烧瓶中,,先在水浴上蒸馏回收苯,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管,蒸馏收集198 -202°C馏分,产品质量约为5.0g。
主要反应试剂及产物的物理常数
| 名称、化学式 | 相对分子质量 | 颜色、状态 | 熔点(°C) | 沸点(°C) | 密度(g/cm3) | 溶解度 | |
| H2O | 苯 | ||||||
| 乙酸酐(CH3CO)2O | 102 | 无色液体 | -73 | 139. 8 | 1.082 | 强烈水解 | 易溶 |
| 苯C6H6 | 78 | 无色液体 | 5.5 | 80.5 | 0.879 | 难溶 | - |
| 氯化铝AlCl3 | 133. 5 | 白色粉末 | 194加压 | 181升华 | 2.44 | 易溶易水解 | 难溶 |
| 苯乙酮C6H5COCH3 | 120 | 无色液体 | 20.5 | 202 | 1.028 | 微溶 | 易溶 |
(1)仪器a的名称是
(2)合成过程中要保证无水的操作环境,其理由是
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致_______ (填标号)。
| A.反应太剧剧烈 | B.液体太多搅不动 |
| C.反应变缓慢 | D.副产物增多 |
(5)分离提纯步骤④中蒸馏收集苯乙酮产品时,改用空气冷凝管的原因是

苯甲酸乙酯(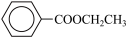 )是重要的精细化工试剂,常用于配制水果型食用香精。某化学兴趣小组通过酯化反应,以苯甲酸和乙醇为原料合成苯甲酸乙酯。
)是重要的精细化工试剂,常用于配制水果型食用香精。某化学兴趣小组通过酯化反应,以苯甲酸和乙醇为原料合成苯甲酸乙酯。
Ⅰ.试剂相关性质如表:
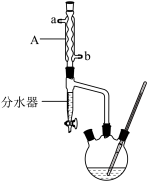
Ⅱ.实验装置如图(部分夹持装置以及加热装置已省去)
Ⅲ.实验步骤如下:
①加料:于100 mL三颈烧瓶中加入:9.8 g苯甲酸、15 mL(约0.25 mol)95%的乙醇和2 mL浓硫酸,摇匀,加沸石。
②加热:小心缓慢加热回流约2 h后,改为蒸馏装置。
③除杂:将瓶中残液倒入盛有20 mL冷水的烧杯中,在搅拌下分批加进 粉末,用pH试纸检验呈中性。
粉末,用pH试纸检验呈中性。
④分离萃取、干燥:分液,水层用10 mL乙醚萃取。合并有机层,加入物质X干燥。
⑤精馏:回收乙醚,加热蒸馏,收集211~213℃馏分,称量产物的质量为9.5 g。
回答下列问题:
(1)步骤①的装置如图所示(加热和夹持装置已略去),仪器A的名称为___________ ;冷却水从___________ (填“a”或“b”)口进入。
(2)写出该法制备苯甲酸乙酯的化学方程式___________ 。
(3)物质X应选择___________ (填选项字母)。
A.碱石灰 B.无水 C.
C.
(4)该反应装置中使用到了分水器,通过分水器不断分离除去反应生成的水,这样做的目的是___________ 。
(5)步骤④中分液操作叙述正确的是___________ (填选项字母)。
A.向盛有水层的分液漏斗中加入乙醚,盖好玻璃塞,将分液漏斗倒转,用力振荡
B.振荡几次后需打开分液漏斗的下口活塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.液体分层后,将分液漏斗上的玻璃塞打开,或使塞上的凹槽对准漏斗上的小孔
E.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
(6)通过计算,本实验的产率是___________ (保留三位有效数字)。
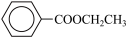 )是重要的精细化工试剂,常用于配制水果型食用香精。某化学兴趣小组通过酯化反应,以苯甲酸和乙醇为原料合成苯甲酸乙酯。
)是重要的精细化工试剂,常用于配制水果型食用香精。某化学兴趣小组通过酯化反应,以苯甲酸和乙醇为原料合成苯甲酸乙酯。Ⅰ.试剂相关性质如表:
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 常温性状 | 无色晶体 | 无色透明液体 | 无色透明液体 |
| 沸点/℃ | 249.0 | 78.0 | 212.6 |
| 相对分子量 | 122 | 46 | 150 |
| 溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |

Ⅲ.实验步骤如下:
①加料:于100 mL三颈烧瓶中加入:9.8 g苯甲酸、15 mL(约0.25 mol)95%的乙醇和2 mL浓硫酸,摇匀,加沸石。
②加热:小心缓慢加热回流约2 h后,改为蒸馏装置。
③除杂:将瓶中残液倒入盛有20 mL冷水的烧杯中,在搅拌下分批加进
④分离萃取、干燥:分液,水层用10 mL乙醚萃取。合并有机层,加入物质X干燥。
⑤精馏:回收乙醚,加热蒸馏,收集211~213℃馏分,称量产物的质量为9.5 g。
回答下列问题:
(1)步骤①的装置如图所示(加热和夹持装置已略去),仪器A的名称为
(2)写出该法制备苯甲酸乙酯的化学方程式
(3)物质X应选择
A.碱石灰 B.无水
(4)该反应装置中使用到了分水器,通过分水器不断分离除去反应生成的水,这样做的目的是
(5)步骤④中分液操作叙述正确的是
A.向盛有水层的分液漏斗中加入乙醚,盖好玻璃塞,将分液漏斗倒转,用力振荡
B.振荡几次后需打开分液漏斗的下口活塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.液体分层后,将分液漏斗上的玻璃塞打开,或使塞上的凹槽对准漏斗上的小孔
E.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
(6)通过计算,本实验的产率是
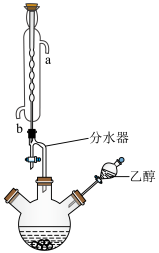
实验室以苯甲酸和乙醇为原料制备苯甲酸乙酯,实验装置如图所示(加热及夹持装置已省略)。
反应原理: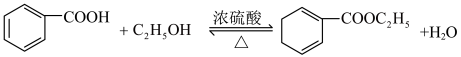
实验步骤如下:
步骤1:在三颈烧瓶中加入12.20 g苯甲酸、20 mL环己烷、5 mL浓硫酸、沸石,并通过分液漏斗加入60 mL乙醇(过量),控制温度在65~70℃加热回流2 h。反应时“环己烷-乙醇-水”会形成共沸物(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去水,回流环己烷和乙醇。
步骤2:反应一段时间,打开旋塞放出分水器中液体,关闭旋塞,继续加热维持反应。
步骤3:将三颈烧瓶内反应液倒入盛有适量水的烧杯中,分批加入 至溶液呈中性。
至溶液呈中性。
步骤4:用分液漏斗分离出有机层,水层用25mL乙醚萃取分液,然后合并至有机层。加入无水氯化钙,一段时间后过滤,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213℃的馏分,得到产品10.00 mL。
请回答下列问题:
(1)制备苯甲酸乙酯时,应采用的加热方式为___________ ,冷凝管中进水口为___________ (填“a”或“b”)。
(2)根据上述实验药品的用量,三颈烧瓶最适宜的规格为___________(填标号)。
(3)下列有关分水器的说法正确的是___________ (填标号)。
A.使用分水器能够促使反应正向进行
B.分水器中的液面不再变化时,反应达到最大限度
(4)加入环己烷的目的是___________ 。
(5)步骤3中若加入 不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是___________ 。
(6)步骤4中对水层用乙醚萃取分液后合并至有机层的目的是___________ 。
(7)本实验中苯甲酸乙酯的产率为___________ (保留三位有效数字)。
反应原理:


| 物质 | 沸点/℃ | 密度/(g·cm3) |
| 苯甲酸 | 249(100℃升华) | 1.27 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.3 | 0.79 |
| 环己烷 | 80.8 | 0.78 |
步骤1:在三颈烧瓶中加入12.20 g苯甲酸、20 mL环己烷、5 mL浓硫酸、沸石,并通过分液漏斗加入60 mL乙醇(过量),控制温度在65~70℃加热回流2 h。反应时“环己烷-乙醇-水”会形成共沸物(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去水,回流环己烷和乙醇。
步骤2:反应一段时间,打开旋塞放出分水器中液体,关闭旋塞,继续加热维持反应。
步骤3:将三颈烧瓶内反应液倒入盛有适量水的烧杯中,分批加入
步骤4:用分液漏斗分离出有机层,水层用25mL乙醚萃取分液,然后合并至有机层。加入无水氯化钙,一段时间后过滤,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213℃的馏分,得到产品10.00 mL。
请回答下列问题:
(1)制备苯甲酸乙酯时,应采用的加热方式为
(2)根据上述实验药品的用量,三颈烧瓶最适宜的规格为___________(填标号)。
| A.100 mL | B.150 mL | C.250 mL | D.500 mL |
A.使用分水器能够促使反应正向进行
B.分水器中的液面不再变化时,反应达到最大限度
(4)加入环己烷的目的是
(5)步骤3中若加入
(6)步骤4中对水层用乙醚萃取分液后合并至有机层的目的是
(7)本实验中苯甲酸乙酯的产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


