解答题-实验探究题 适中0.65 引用1 组卷108
GaN材料的研究与应用是目前全球半导体研究的前沿和热点,是研制微电子器件、光电子器件的新型半导体材料,GaN属于第三代半导体材料。
(1)GaN、GaP、GaAs都是良好的半导体材料,晶体结构相似。熔点分别为:1700℃(GaN)、1480℃(GaP)、1238℃(GaAs),其熔点变化的原因为_______ 。
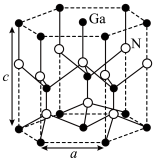
(2)GaN的晶胞结构如图所示,每个Ga原子周围距离最近的N原子个数为_______ 个。
Ⅰ.为生成GaN,首先要得到有机镓源,即有机镓。
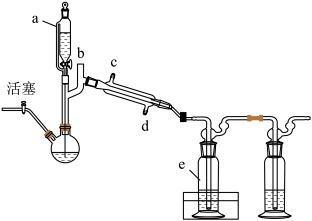
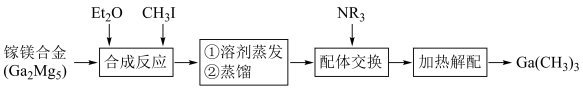
(3)有机镓 的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚(
的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚( )溶剂的容器内加入镓镁(
)溶剂的容器内加入镓镁( )合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到
)合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到 的配合物。将配合物加入高沸点有机胺
的配合物。将配合物加入高沸点有机胺 中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度
中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度 。
。
①反应仪器a的名称为____ 。三颈烧瓶中除生成 外,还有
外,还有 和
和 生成,该反应的化学方程式为
生成,该反应的化学方程式为______ 。
②工业上不采用直接分解 ,而采用先将
,而采用先将 加入高沸点有机胺
加入高沸点有机胺 ,中,再在真空条件下分解
,中,再在真空条件下分解 的原因为
的原因为_______ 。
已知相关物质的沸点信息如下表:
Ⅱ.MOCVD生产GaN的示意图如下:
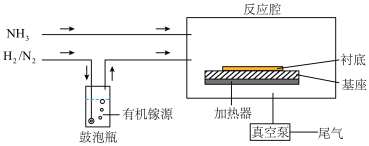
(4)采用多孔球泡的原因是_______ ,制取GaN的化学反应方程式为_______ 。
(5)工业上采用真空泵抽取尾气的原因为_______ 。
(1)GaN、GaP、GaAs都是良好的半导体材料,晶体结构相似。熔点分别为:1700℃(GaN)、1480℃(GaP)、1238℃(GaAs),其熔点变化的原因为
(2)GaN的晶胞结构如图所示,每个Ga原子周围距离最近的N原子个数为

Ⅰ.为生成GaN,首先要得到有机镓源,即有机镓。
(3)有机镓

①反应仪器a的名称为
②工业上不采用直接分解
已知相关物质的沸点信息如下表:
| 物质 | |||
| 沸点/℃ | 55.8 | 34.5 | 365.8 |
Ⅱ.MOCVD生产GaN的示意图如下:

(4)采用多孔球泡的原因是
(5)工业上采用真空泵抽取尾气的原因为
2024·湖南娄底·一模
类题推荐
三甲基镓 是制造氮化镓光电材料和GaAs太阳能电池的源材料,其制备工艺流程如下:
是制造氮化镓光电材料和GaAs太阳能电池的源材料,其制备工艺流程如下: (乙醚)为溶剂,同时
(乙醚)为溶剂,同时 和
和 在流程中均作配体;相关物质沸点如下:
在流程中均作配体;相关物质沸点如下:
回答下列问题:
(1)三甲基镓固态时的晶体类型为______ 。“合成反应”中除生成 外,还有
外,还有 和
和 生成,该反应的化学方程式为
生成,该反应的化学方程式为______ 。
(2)实验室用蒸馏装置模拟“溶剂蒸发”操作。当______ 时停止加热,溶剂蒸发结束。与直接分解 制备
制备 相比,采用“
相比,采用“ 配体交换”工艺制备的产品纯度更高的原因是
配体交换”工艺制备的产品纯度更高的原因是______ 。
(3)该流程中可以循环利用的物质有______ 。
(4)以三甲基镓为原料,使其与 发生反应得到GaN和另一种产物,该反应的化学方程式为
发生反应得到GaN和另一种产物,该反应的化学方程式为______ 。
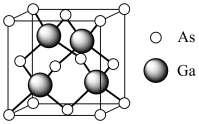
(5)共价晶体GaAs的晶胞为立方体,结构如图所示,紧邻的As原子之间的距离为a,紧邻的As、Ga原子之间的距离为b,则
______ 。
物质 | ||||
沸点/℃ | 55.7 | 34.6 | 42.4 | 365.8 |
(1)三甲基镓固态时的晶体类型为
(2)实验室用蒸馏装置模拟“溶剂蒸发”操作。当
(3)该流程中可以循环利用的物质有
(4)以三甲基镓为原料,使其与
(5)共价晶体GaAs的晶胞为立方体,结构如图所示,紧邻的As原子之间的距离为a,紧邻的As、Ga原子之间的距离为b,则
2—氯乙醇是一种重要的有机化工原料,溶于水,受热时易分解.通常是以适量的2—氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2—氯乙醇。制取反应装置及部分实验药品及物理量如图所示。

原应原理为: (g)+HCl(g)
(g)+HCl(g) ClCH2CH2OH(l)
ClCH2CH2OH(l)
制取与测定实验步骤如下:
Ⅰ.2—氯乙醇的制取
①将溶剂2—氯乙醇加入三颈烧瓶中,启动搅拌器;
②分别将氯化氢与环氧乙烷两种气体按6:5物质的量的配比通入反应器中,使其在溶剂中充分溶解反应;
③反应温度控制在30℃,持续反应100min;
④采用减压蒸馏、收集产品。
(1)实验装置A、B中均用到了浓硫酸,分别体现的浓硫酸的性质为___ ,___ 。
(2)写出实验步骤中提高环氧乙烷利用率的措施___ ,___ (写出两点)。
(3)在步骤④中,采用减压蒸馏的原因是___ 。
Ⅱ.2—氯乙醇样品中Cl元素的测定
已知:a.Ksp(AgCl)=1.8×10-10、Ksp(AgSCN)=1.0×10-12
b.2—氯乙醇样品中还含有一定量的氯化氢和其他杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1。
测定步骤:①取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;待反应完全后加稀硝酸至酸性;
②加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
③向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
④加入指示剂,用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+至终点,消耗NH4SCN溶液10.00mL;
⑤另取样品1.00mL加水稀释至10.00mL,用pH计测定,测得溶液pH为1.00。
(4)ClCH2CH2OH与NaOH反应生成NaCl和另一种物质,该物质的分子式为___ 。
(5)步骤③中加入硝基苯的目的是___ ,若无此操作,则所测样品中Cl元素含量将___ 。填(“偏大”、“偏小”或“不变”)。
(6)步骤④中选用的指示剂可以是下列的___ 。(选填序号)
(7)根据实验测定的数据计算,样品中2—氯乙醇的质量分数为___ 。

| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112.2 | 10.8 |
| 2—氯乙醇 | 80.5 | 67.5 | 128.8 |
 (g)+HCl(g)
(g)+HCl(g)制取与测定实验步骤如下:
Ⅰ.2—氯乙醇的制取
①将溶剂2—氯乙醇加入三颈烧瓶中,启动搅拌器;
②分别将氯化氢与环氧乙烷两种气体按6:5物质的量的配比通入反应器中,使其在溶剂中充分溶解反应;
③反应温度控制在30℃,持续反应100min;
④采用减压蒸馏、收集产品。
(1)实验装置A、B中均用到了浓硫酸,分别体现的浓硫酸的性质为
(2)写出实验步骤中提高环氧乙烷利用率的措施
(3)在步骤④中,采用减压蒸馏的原因是
Ⅱ.2—氯乙醇样品中Cl元素的测定
已知:a.Ksp(AgCl)=1.8×10-10、Ksp(AgSCN)=1.0×10-12
b.2—氯乙醇样品中还含有一定量的氯化氢和其他杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1。
测定步骤:①取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;待反应完全后加稀硝酸至酸性;
②加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
③向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
④加入指示剂,用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+至终点,消耗NH4SCN溶液10.00mL;
⑤另取样品1.00mL加水稀释至10.00mL,用pH计测定,测得溶液pH为1.00。
(4)ClCH2CH2OH与NaOH反应生成NaCl和另一种物质,该物质的分子式为
(5)步骤③中加入硝基苯的目的是
(6)步骤④中选用的指示剂可以是下列的
| A.淀粉溶液 | B.酚酞溶液 | C.NH4Fe(SO4)2溶液 | D.NaCl溶液 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网