解答题-原理综合题 适中0.65 引用1 组卷74
回答下列问题
(1)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g) ΔH1>0
SiHCl3(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3
反应③的ΔH3=___________ (用ΔH1,ΔH2表示)。
(2)用惰性电极电解一定浓度的硫酸铜溶液一段时间后,若要恢复到电解前的浓度,须向所得的溶液中加入0.3molCu(OH)2。此电解过程中两个电极共放出气体为___________ mol,若要恢复到电解前的浓度,还可加入0.3mol___________ 和0.3molH2O。
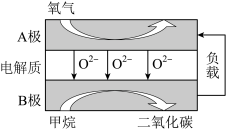
(3)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池示意图如图:
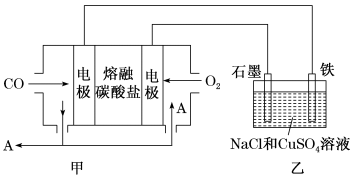
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。该电池负极电极反应为___________ 。
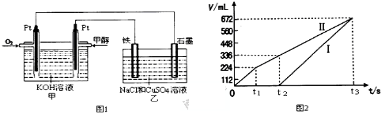
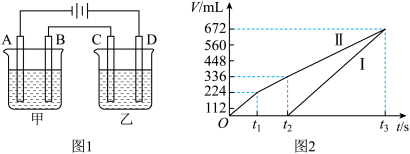
(4)用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如乙图。理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(体积为标准状况下的体积)。
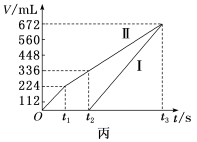
①写出在t1后,石墨电极上的电极反应:___________ ;原NaCl溶液物质的量浓度为___________ mol·L-1(假设溶液体积不变)。
②当向上述甲装置中通入标准状况下的氧气336mL时,理论上在铁电极上可析出铜的质量为___________ g。
(1)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)
②3SiCl4(g)+2H2(g)+Si(s)
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)
反应③的ΔH3=
(2)用惰性电极电解一定浓度的硫酸铜溶液一段时间后,若要恢复到电解前的浓度,须向所得的溶液中加入0.3molCu(OH)2。此电解过程中两个电极共放出气体为
(3)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池示意图如图:

为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。该电池负极电极反应为
(4)用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如乙图。理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(体积为标准状况下的体积)。

①写出在t1后,石墨电极上的电极反应:
②当向上述甲装置中通入标准状况下的氧气336mL时,理论上在铁电极上可析出铜的质量为
23-24高二上·福建南平·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网