解答题-原理综合题 适中0.65 引用1 组卷218
燃煤烟气中含有 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。
(1)已知:






用 、
、 表示
表示 ,
,
___________ 。
(2)气体转化:
 。
。
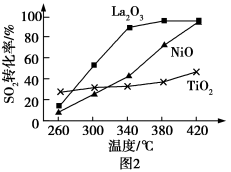
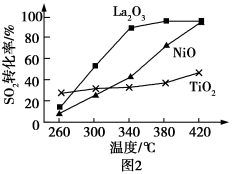
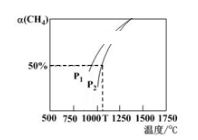
①相同条件下,分别选取 、NiO、
、NiO、 作上述反应的催化剂时,
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是___________ 。
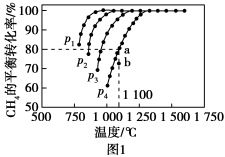
②若在2L恒容密闭容器中,将3mol CO、1mol 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=___________ 。
③向反应容器中再分别通入下列气体,可以使 转化率增大的是
转化率增大的是___________ (填字母)。
a.CO b. c.
c. d.
d.
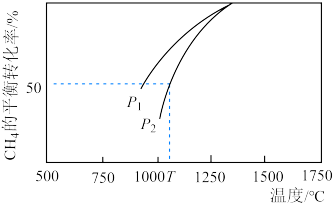
(3) 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
___________  (填“>”或“<”=)。若
(填“>”或“<”=)。若 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
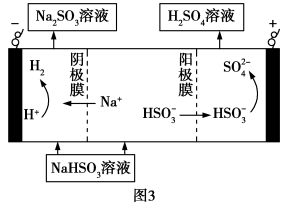
(4) 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中
___________  ,此时溶液pH=a,
,此时溶液pH=a, [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
___________ (用含a、b、c的式子表示)。(已知 的两步电离常数
的两步电离常数 ,
, )
)
(1)已知:
用
(2)气体转化:
①相同条件下,分别选取

②若在2L恒容密闭容器中,将3mol CO、1mol
③向反应容器中再分别通入下列气体,可以使
a.CO b.
(3)

(4)
2024·天津和平·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CO(g)+H2O(g)
CO(g)+H2O(g)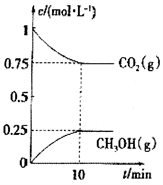
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步: