解答题-原理综合题 适中0.65 引用1 组卷145
CO2的回收与利用是低碳环保研究的热点课题
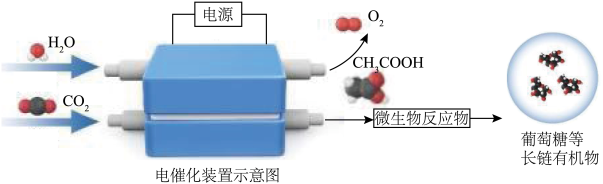
(1)利用二氧化碳合成高浓度乙酸,进一步利用微重物合成葡萄糖等长链有机物。其合成示意图如下,写出生成乙酸的电极反应式_______ 。
(2)燃料的热值和 排放量如下表所示
排放量如下表所示
①根据上表数据,计算 (l)的燃烧热(△H)为
(l)的燃烧热(△H)为_______  。
。
A.-726.4 B.-1452.8 C.22.7 D.-22.7
②根据上表数据,从 排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因
排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因_______ 。
(3)以 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一、其反应原理为:
资源化利用的方式之一、其反应原理为:
 。
。
①下图中,曲线_______ 能表示该反应的平衡常数K与温度T的关系。
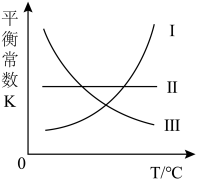
A.I B.Ⅱ C.Ⅲ
②某温度下,向容积为2.0L恒容密闭容器中充入1.0mol (g)和3.0mol
(g)和3.0mol (g)模拟上述反应。反应达到平衡状态时,测得
(g)模拟上述反应。反应达到平衡状态时,测得 。该温度下,平衡常数K=
。该温度下,平衡常数K=_______ 。
(4)在不同温度下,向等容积的反应器中,分别通入等量、相同比例的 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO:
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO: 
 。
。

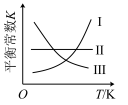
①图中一定不处于化学平衡状态的是_______ 。
A.点A B.点B C.点C D.点D
②已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有_______ 、_______ 。
(1)利用二氧化碳合成高浓度乙酸,进一步利用微重物合成葡萄糖等长链有机物。其合成示意图如下,写出生成乙酸的电极反应式

(2)燃料的热值和
| 燃料 | 煤油 | ||
| 热值( | 22.47 | 50.4 | 29.0 |
| 16.5 | 16.2 | 22.9 |
A.-726.4 B.-1452.8 C.22.7 D.-22.7
②根据上表数据,从
(3)以
①下图中,曲线

A.I B.Ⅱ C.Ⅲ
②某温度下,向容积为2.0L恒容密闭容器中充入1.0mol
(4)在不同温度下,向等容积的反应器中,分别通入等量、相同比例的

①图中一定不处于化学平衡状态的是
A.点A B.点B C.点C D.点D
②已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有
2024·天津河东·一模
类题推荐
杭州亚运会主火炬塔燃料使用的甲醇被誉为绿色燃料。在以往的运动会中,丙烷、煤油也曾作为燃料使用。上述燃料的热值和 排放量如下表所示:
排放量如下表所示:
(1)根据上表数据,计算 的燃烧热为___________
的燃烧热为___________ 。
。
(2)根据上表,从 排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因
排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因___________ 。
以 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一、其反应原理为:
资源化利用的方式之一、其反应原理为:
(3)下图中,曲线___________ 能表示该反应的平衡常数K与温度T的关系。
A.I B.II C.III
(4)某温度下,向容积为2.0L的恒容密闭容器中充入 和
和 模拟上述反应。反应达到平衡状态时,测得
模拟上述反应。反应达到平衡状态时,测得 。该温度下,平衡常数
。该温度下,平衡常数 ___________。
___________。
在不同温度下,向等容积的反应器中,分别通入等量、相同比例的 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO:
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO: 。
。

(5)图中一定不处于化学平衡状态的点是___________。
(6)已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有___________ 、___________ 。
光催化可以加快合成甲醇的反应速率,下图是该反应的部分历程,其中吸附在催化剂表面的物质用*表示。

(7)上图虚线框中的基元反应,主要决定总反应速率快慢的是___________。
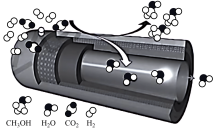
上海某研究团队研制出了一种具有反应和分离“双功能分子师催化膜”反应器,使用该反应器制甲醇时,能大幅度提高二氧化碳转化率,其原理如下图所示:
CO2+3H2 CH3OH+H2O
CH3OH+H2O
在不同反应器中, 平衡转化率和甲醇选择性
平衡转化率和甲醇选择性 的相关实验数据如下表所示:
的相关实验数据如下表所示:
(8)从绿色化学的角度,分析该双功能分子筛催化膜反应器的优点有:
① 平衡转化率明显升高;
平衡转化率明显升高;
②___________ ;
③___________ 。
| 燃料 | 煤油 | ||
| 热值 | 22.7 | 50.4 | 29.0 |
| 16.5 | 16.2 | 22.9 |
(1)根据上表数据,计算
| A.22.7 | B. | C. | D. |
(2)根据上表,从
以
(3)下图中,曲线

A.I B.II C.III
(4)某温度下,向容积为2.0L的恒容密闭容器中充入
| A.3.00 | B.0.33 | C.0.15 | D.0.59 |
在不同温度下,向等容积的反应器中,分别通入等量、相同比例的

(5)图中一定不处于化学平衡状态的点是___________。
| A.点A | B.点B | C.点C | D.点D |
(6)已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有
光催化可以加快合成甲醇的反应速率,下图是该反应的部分历程,其中吸附在催化剂表面的物质用*表示。

(7)上图虚线框中的基元反应,主要决定总反应速率快慢的是___________。
| A. | B. |
| C. | D. |
上海某研究团队研制出了一种具有反应和分离“双功能分子师催化膜”反应器,使用该反应器制甲醇时,能大幅度提高二氧化碳转化率,其原理如下图所示:
CO2+3H2

在不同反应器中,
| 实验组 | 反应器 | 压强/MPa | 温度/K | 甲醇选择性/% | ||
| ① | 普通催化反应器 | 3 | 533 | 3 | 21.9 | 67.3 |
| ② | 双功能分子筛催化膜反应器 | 36.1 | 100 |
(8)从绿色化学的角度,分析该双功能分子筛催化膜反应器的优点有:
①
②
③
二氧化碳的回收利用是环保领域研究热点。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。

(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g) CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比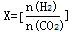 的关系如右图所示。
的关系如右图所示。

①平衡常数KA KB
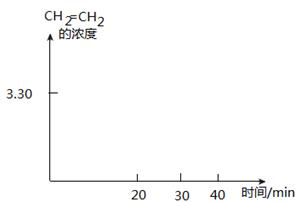
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2 B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g) CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0

上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。

(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2
 CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:CO2(g)+3H2(g)
 CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g)
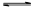 CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比
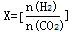 的关系如右图所示。
的关系如右图所示。
①平衡常数KA KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2 B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。

(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g)
 CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0B.2CO2(g) + 6H2(g)
 CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0
上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



