解答题-工业流程题 适中0.65 引用1 组卷204
I.V2O5是一种重要的工业催化剂。
(1)V2O5催化剂参与SO2催化氧化反应的机理如图。

V5+催化过程可以表示为:
①……
②O2+4V4+=4V5++2O2-
①的离子方程式是___________ 。
Ⅱ.某V2O5失活催化剂(主要含V2O5、V2O4、SiO2、SO3以及少量的Fe等)是重要的含钒二次资源。从失活催化剂提取钒的一种工艺流程如下。
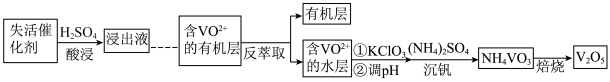
资料:
ⅰ.HA(有机酸性萃取剂)对金属阳离子的萃取能力由强到弱的顺序为:Fe3+>VO2+>VO >Fe2+;
>Fe2+;
ⅱ.溶液pH<4.0时,+5价钒的存在形式为VO ,6.0≤pH≤8.0时,正五价钒元素的存在形式为VO
,6.0≤pH≤8.0时,正五价钒元素的存在形式为VO ,且二者可相互转化:VO
,且二者可相互转化:VO +H2O
+H2O VO
VO +2H+。
+2H+。
(2)浸出液中含有VO 、VO2+、Fe3+、Fe2+等阳离子,浸出VO
、VO2+、Fe3+、Fe2+等阳离子,浸出VO 的离子方程式是
的离子方程式是___________ 。
(3)流程中“……”包含的操作顺序为___________ 。
(4)“萃取”“反萃取”过程机理为:VO2+(水层)+2HA(有机层) VOA2(有机层)+2H+(水层)。反萃取剂选择H2SO4,原因是
VOA2(有机层)+2H+(水层)。反萃取剂选择H2SO4,原因是___________ 。
(5)“沉钒”过程中需先加入KClO3,然后通入氨气调节pH为6~8,再加(NH4)2SO4。
①加入KClO3,反应的离子方程式是___________ 。
②结合平衡移动原理解释通入氨气的作用___________ 。
(6)产品中V2O5纯度的测定方法如下。

已知:此过程中,MnO 可氧化Fe2+,且不与VO2+反应。产品中的杂质不参与反应。
可氧化Fe2+,且不与VO2+反应。产品中的杂质不参与反应。
步骤iii中标准KMnO4溶液的浓度和消耗的体积分别为c和V,计算产品中V2O5的纯度还需要的实验数据有___________ 。
(1)V2O5催化剂参与SO2催化氧化反应的机理如图。

V5+催化过程可以表示为:
①……
②O2+4V4+=4V5++2O2-
①的离子方程式是
Ⅱ.某V2O5失活催化剂(主要含V2O5、V2O4、SiO2、SO3以及少量的Fe等)是重要的含钒二次资源。从失活催化剂提取钒的一种工艺流程如下。

资料:
ⅰ.HA(有机酸性萃取剂)对金属阳离子的萃取能力由强到弱的顺序为:Fe3+>VO2+>VO
ⅱ.溶液pH<4.0时,+5价钒的存在形式为VO
(2)浸出液中含有VO
(3)流程中“……”包含的操作顺序为
(4)“萃取”“反萃取”过程机理为:VO2+(水层)+2HA(有机层)
(5)“沉钒”过程中需先加入KClO3,然后通入氨气调节pH为6~8,再加(NH4)2SO4。
①加入KClO3,反应的离子方程式是
②结合平衡移动原理解释通入氨气的作用
(6)产品中V2O5纯度的测定方法如下。

已知:此过程中,MnO
步骤iii中标准KMnO4溶液的浓度和消耗的体积分别为c和V,计算产品中V2O5的纯度还需要的实验数据有
2024·北京顺义·一模
类题推荐
工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、SiO2、Fe2O3等杂质),低温硫酸化焙烧—水浸工艺制备V2O5,其流程如图:

资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO +8H2O
+8H2O H2V10O
H2V10O +14H+
+14H+
ⅴ.氢氧化物完全沉淀时溶液的pH表
(1)焙烧过程中向石煤中加硫酸焙烧,将V2O3转化为VOSO4的化学方程式是____ 。
(2)预处理过程中先加入Na2SO3溶液进行还原预处理,加入Na2SO3溶液的第一个作用是将V(V)还原为V(IV)减少钒的损失,再用氨水混合并调节溶液pH。
①请结合相关离子方程式,说明加入Na2SO3的第二个作用____ 。
②解释加氨水调节pH≈5的原因是____ 。
(3)上述I的具体操作为____ 。
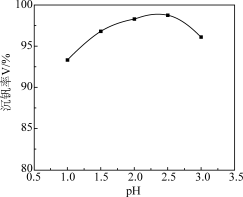
(4)沉钒过程中先加入NaClO3进行氧化,再加氨水调节pH,铵盐会将H2V10O 中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是
中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是____ 。
(5)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是____ 。(V2O5的摩尔质量:182g•mol-1)

资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO
ⅴ.氢氧化物完全沉淀时溶液的pH表
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 完全沉淀 | 3.2 | 9.0 | 4.7 |
(2)预处理过程中先加入Na2SO3溶液进行还原预处理,加入Na2SO3溶液的第一个作用是将V(V)还原为V(IV)减少钒的损失,再用氨水混合并调节溶液pH。
①请结合相关离子方程式,说明加入Na2SO3的第二个作用
②解释加氨水调节pH≈5的原因是
(3)上述I的具体操作为
(4)沉钒过程中先加入NaClO3进行氧化,再加氨水调节pH,铵盐会将H2V10O

(5)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网





