解答题-原理综合题 较难0.4 引用1 组卷57
绿色能源是当今重要的研究热点,2022年3月12日,中科院大连化物所的 制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
Ⅰ. 甲烷化反应为:
甲烷化反应为: ,该反应又称Sabatier反应。
,该反应又称Sabatier反应。
(1)相关的化学键键能数据如下表所示:
Sabatier反应的
__________  。
。
(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:__________ (写一点即可)。
(3)在体积为 的恒温密闭容器中,投入
的恒温密闭容器中,投入 、
、 进行上述反应,达到平衡后,若
进行上述反应,达到平衡后,若 的转化率为20%,则该反应的平衡常数为
的转化率为20%,则该反应的平衡常数为
__________  (写计算式)。
(写计算式)。
(4) 转化为
转化为 也可通过电化学反应实现,其原理如图所示:
也可通过电化学反应实现,其原理如图所示:
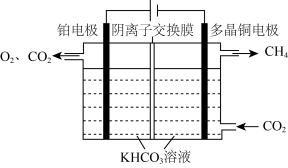
电解过程中,阴极室和阳极室的 溶液浓度基本保持不变,阴极的电极反应式为
溶液浓度基本保持不变,阴极的电极反应式为__________ ;若生成 理论上阳极室生成混合气体的体积为
理论上阳极室生成混合气体的体积为__________ L(标准状况,忽略气体的溶解)。
(5) 是共价化合物,分子中所有的原子都达到稳定结构,
是共价化合物,分子中所有的原子都达到稳定结构, 此分子中含有
此分子中含有__________ mol共用电子对,试写出其分子的结构式:__________ 。
Ⅰ.
(1)相关的化学键键能数据如下表所示:
化学键 | H—H | H—O | C—H | C=O |
436 | 463 | 413 | 803 |
(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:
(3)在体积为
(4)

电解过程中,阴极室和阳极室的
(5)
2024·江西新余·一模
类题推荐
CO2 资源化对环境保护具有重大意义,因此将CO2转化为CH4的技术成为科学研究的热点。CO2甲烷化反应为: CO2(g) +4H2(g)==CH4(g) +2H2O(g),该反应又称Sabatier反应。回答下列问题:
(1)已知: CH4(g) +2O2(g)=CO2(g) +2H2O(g) ∆H1
2H2(g) +O2(g)=2H2O(g) △H2
相关的化学键键能数据如下表所示:
Sabatier反应的∆H=____ (用 ∆H1、∆H2表示),根据上表数据估算∆H____ kJ . mol -1。
(2)在一定温度下,提高CO2平衡转化率的方法有_____ 、_____ 。
(3)其他条件一定时,不同压强下,CO2的转化率和CH4的产率如图所示:

CO2甲烷化应该选择的压强约为____ Mpa; CH4的产率小于CO2转化率的原因是_____________ 。
(4)在总压为p MPa的恒温恒压密闭容器中,投入1molCO2. 4 mol H2进行上述反应,达到平衡后,若CO2的转化率和CH4的产率均为 ,则该反应的平衡常数Kp=
,则该反应的平衡常数Kp= _______ ( 用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5) CO2 转化为CH4也可通过电化学反应实现,其原理如图所示。
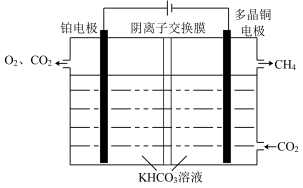
电解过程中,阴极室,阳极室的KHCO3溶液浓度基本保持不变。阴极的电极反应式为________ ; 若生成1 mol CH4. 理论上阳极室生成混合气体的体积为_____ l, (标准状况,忽略气体的溶解)。
(1)已知: CH4(g) +2O2(g)=CO2(g) +2H2O(g) ∆H1
2H2(g) +O2(g)=2H2O(g) △H2
相关的化学键键能数据如下表所示:
| 化学键 | H-H | H-O | C-H | C=O |
| E(kJ/mol) | 436 | 463 | 413 | 803 |
Sabatier反应的∆H=
(2)在一定温度下,提高CO2平衡转化率的方法有
(3)其他条件一定时,不同压强下,CO2的转化率和CH4的产率如图所示:

CO2甲烷化应该选择的压强约为
(4)在总压为p MPa的恒温恒压密闭容器中,投入1molCO2. 4 mol H2进行上述反应,达到平衡后,若CO2的转化率和CH4的产率均为
(5) CO2 转化为CH4也可通过电化学反应实现,其原理如图所示。

电解过程中,阴极室,阳极室的KHCO3溶液浓度基本保持不变。阴极的电极反应式为
建设生态文明,研究碳的化合物对减少CO2在大气中累积及实现可再生能源的有效利用具有重要意义。
(1)已知有关化学键的键能E数据如下
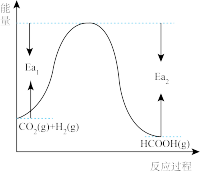
CO2和H2在一定条件下能发生反应:CO2(g)+H2(g)⇌HCOOH(g),该反应的活化能为akJ·mol-1,其反应过程如图所示,则Ea2=_______ kJ/mol(用含a的代数式表示)
(2)该反应在_______ (填“高温”或“低温”)能自发进行。
(3)一定温度下,在一刚性密闭容器中,充入等物质的量的CO2和H2,此时容器的压强为48kPa,发生以上反应,6min时达到平衡,此时容器压强为30KPa,则0~6min内用H2的分压表示反应速率为_______ 。该温度下,此反应的平衡常数KP=_______ (KP是平衡分压代替平衡浓度计算的平衡常数)。
(4)恒温恒容条件下,为了提高CO2的转化率,可采取的措施为_______ (写一点即可),能说明该反应达到平衡状态的是_______ (填字母)。
A.混合气体的密度不再变化
B.甲酸的浓度不变
C.CO2的消耗速率与HCOOH的生成速率相等
D.混合气体的平均相对分子质量不再变化
(5)利用太阳能电池电解能实现CO2转化为HCOOH,如图所示。
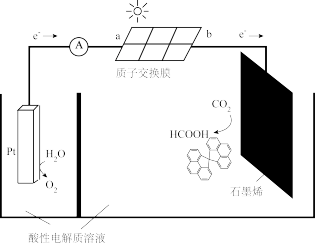
①电解过程中,b极发生的电极反应式为_______
②每转移1mol电子,阳极区溶液质量减轻_______ g。
(1)已知有关化学键的键能E数据如下
| 化学键 | C=O | H—H | C—H | C—O | O—H |
| E/(KJ·mol-1) | 745 | 436 | 413 | 356 | 463 |

(2)该反应在
(3)一定温度下,在一刚性密闭容器中,充入等物质的量的CO2和H2,此时容器的压强为48kPa,发生以上反应,6min时达到平衡,此时容器压强为30KPa,则0~6min内用H2的分压表示反应速率为
(4)恒温恒容条件下,为了提高CO2的转化率,可采取的措施为
A.混合气体的密度不再变化
B.甲酸的浓度不变
C.CO2的消耗速率与HCOOH的生成速率相等
D.混合气体的平均相对分子质量不再变化
(5)利用太阳能电池电解能实现CO2转化为HCOOH,如图所示。

①电解过程中,b极发生的电极反应式为
②每转移1mol电子,阳极区溶液质量减轻
煤化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目,该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是化合反应,写出化学反应方程式___________ 。
(2)反应Ⅰ中生成1molCH3OH放出aKJ的能量,拆开1mol化学键所需的能量(E)的相关数据如下:
根据相关数据计算拆开1molC O所需的能量E1=
O所需的能量E1=___________ kJ。
(3)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是___________ (填一项即可)
(4)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是___________ 。
a.单位时间消耗nmolCO2的同时,消耗3nmol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(5)一定温度下,若上述反应II在体积为2L的密闭容器中进行并保持温度不变,起始时投入1molCO2、4molH2达到平衡时H2与CO2的物质的量之比为8:1,CO2的转化率是___________ 。
(6)H2还原CO2电化学法制备甲醇的工作原理如下图所示:

通入H2的一端是电池的___________ 极(填“正”或“负”),通入CO2的一端发生的电极反应式为___________ 。
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇CO2(g)+3H2(g)
(1)上述反应Ⅰ是化合反应,写出化学反应方程式
(2)反应Ⅰ中生成1molCH3OH放出aKJ的能量,拆开1mol化学键所需的能量(E)的相关数据如下:
| 化学键 | H—H | C—O | CO中的C | H—O | C—H |
| E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC
(3)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是
(4)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是
a.单位时间消耗nmolCO2的同时,消耗3nmol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(5)一定温度下,若上述反应II在体积为2L的密闭容器中进行并保持温度不变,起始时投入1molCO2、4molH2达到平衡时H2与CO2的物质的量之比为8:1,CO2的转化率是
(6)H2还原CO2电化学法制备甲醇的工作原理如下图所示:

通入H2的一端是电池的
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


