解答题-结构与性质 较易0.85 引用1 组卷114
砷元素(As)广泛分布于自然界中,土壤、水体、矿物和生物体内都含有微量的砷。工业上提取砷的某步反应如下:

(1)砷元素在周期表中的位置是___________ 。
(2)沸点:AsH3___________ NH3,原因是___________ 。
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
(4)已知H3AsO3为三元弱酸,则分子中As原子存在___________ 对孤电子对,AsO 的空间构型为
的空间构型为___________ 。
A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4 H2AsO
H2AsO +H+,H2AsO
+H+,H2AsO
 HAsO
HAsO +H+,HAsO
+H+,HAsO
 AsO
AsO +H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因
+H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因___________ 。
(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。
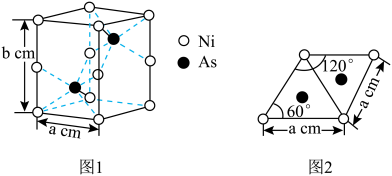
该晶胞中含有___________ 个Ni原子。该晶体的密度 ρ =___________ g·cm-3。(设NA为阿伏加德罗常数,该晶体的摩尔质量为M g·mol-1,用含 a、b、M和NA的代数式表示。)

(1)砷元素在周期表中的位置是
(2)沸点:AsH3
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
| A.I中仅有σ键 | B.Ⅱ中部分元素的第一电离能: |
| C.Ⅲ中含有的元素中砷的电负性最大 | D.Ⅳ中含有的化学键为离子键、共价键 |
(4)已知H3AsO3为三元弱酸,则分子中As原子存在
A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4
(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。

该晶胞中含有
2024·上海金山·一模
类题推荐
氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3===Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)基态S的价电子排布图为____________ 。
(2)下列关于物质结构与性质的说法,正确的是________ 。
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测 的空间构型为
的空间构型为______ ,中心原子S的杂化方式为________ ,[Ag(S2O3)2]3-中存在的化学键有________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因___________ 。
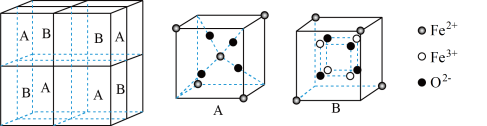
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为_____ ,已知该晶体的晶胞参数为a nm,阿伏加 德罗常数的值为NA,则密度ρ为______ g·cm-3(用含a和NA的代数式表示)。
(1)基态S的价电子排布图为
(2)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
| 元素 | Al | Si | P | S | Cl |
| E1/(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为

第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是______ 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
Mn原子价电子排布式为__________ ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是___________________________ 。
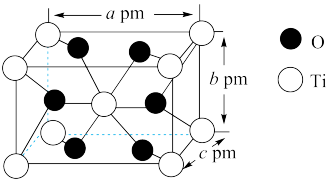
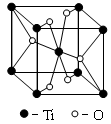
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于____________ 区。Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为____________ 。
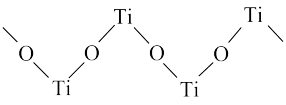
(4)某铁的化合物结构简式如图所示
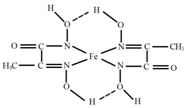
①组成上述化合物中各非金属元素电负性由大到小的顺序为___________ (用元素符号表示)。
②在图中用“→”标出亚铁离子的配位键_______ 。
(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为_______ ,这几个O2-构成的空间构型为_____________ 。已知Ni2+与O2-的核间距为anm,NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为________ g/cm3。
(1)下列叙述正确的是
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
Mn原子价电子排布式为
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于

(4)某铁的化合物结构简式如图所示

①组成上述化合物中各非金属元素电负性由大到小的顺序为
②在图中用“→”标出亚铁离子的配位键
(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网