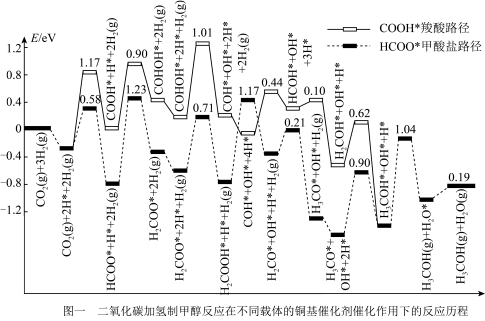解答题-原理综合题 较难0.4 引用1 组卷72
二氧化碳捕集、利用和封存是减少化石能源发电和工业过程中 排放的关键技术。减少碳排放的方法还有很多,
排放的关键技术。减少碳排放的方法还有很多, 转化成其他化合物可有效实现碳循环,如下反应:
转化成其他化合物可有效实现碳循环,如下反应:
a.
b.
c.
d.
回答下列问题:
(1)已知:原子利用率 ,上述反应中原子利用率最高的是
,上述反应中原子利用率最高的是_______ (填标号)。
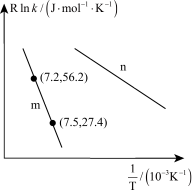
(2)著名的 经验公式为
经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,兴趣小组对反应b进行了实验探究,并依据实验数据获得如图曲线。在m催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,兴趣小组对反应b进行了实验探究,并依据实验数据获得如图曲线。在m催化剂作用下,该反应的活化能
_______  ,从图中信息获知催化效能较高的催化剂是
,从图中信息获知催化效能较高的催化剂是_______ (填“m”或“n”)。
(3)通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值)认识反应b制备甲醇在不同催化条件下存在的两种反应路径:
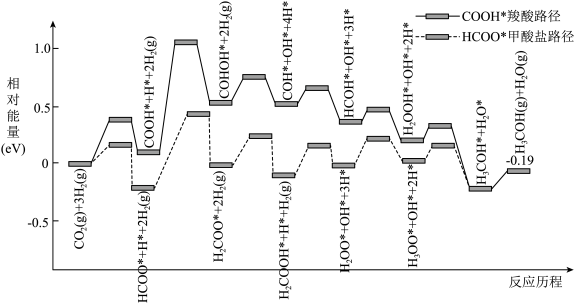
根据势能图,判断下列说法正确的是_______(填标号)。
(4)反应d中, 将等物质的量
将等物质的量 和
和 充入恒压
充入恒压 的密闭容器中。已知逆反应速率
的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下 。反应达平衡时测得
。反应达平衡时测得 。
。 的平衡转化率为
的平衡转化率为_______ ,该温度下反应的压强平衡常数
_______ (用各组分的分压计算平衡常数)。
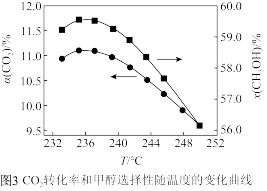
(5)向恒容密闭容器中以物质的量之比为 充入
充入 和
和 ,发生反应c和反应d,实验测得平衡体系中各组分的体积分数与温度的关系如图所示。其中表示
,发生反应c和反应d,实验测得平衡体系中各组分的体积分数与温度的关系如图所示。其中表示 的体积分数与温度关系的曲线为
的体积分数与温度关系的曲线为_______ (填“ ”“
”“ ”或“
”或“ ”);
”); 之后,
之后, 平衡体积分数随温度的变化程度小于
平衡体积分数随温度的变化程度小于 平衡体积分数随温度的变化程度,原因为
平衡体积分数随温度的变化程度,原因为_______ 。

a.
b.
c.
d.
回答下列问题:
(1)已知:原子利用率
(2)著名的

(3)通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值)认识反应b制备甲醇在不同催化条件下存在的两种反应路径:

根据势能图,判断下列说法正确的是_______(填标号)。
| A.提高 |
| B.甲酸盐路径的决速步反应是 |
| C.中间体 |
| D.使用高活性催化剂可降低反应焓变,加快反应速率 |
(4)反应d中,
(5)向恒容密闭容器中以物质的量之比为

2024·吉林白山·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网