解答题-原理综合题 适中0.65 引用1 组卷123
氮的氧化物是大气主要污染物,研究含氮物质间的转化是环境科学的重要课题。
(1)①在恒温恒容的密闭容器中充入1mol 和3mol
和3mol 发生反应生成
发生反应生成 ,下列能说明反应达到平衡状态的是
,下列能说明反应达到平衡状态的是_______ (填标号)。
A. B.容器内压强不变
B.容器内压强不变
C.气体的密度不再改变 D.容器内气体的平均摩尔质量不变
②以 为还原剂,在催化剂作用下选择性地与
为还原剂,在催化剂作用下选择性地与 发生氧化还原反应生成
发生氧化还原反应生成 和
和 。已知:
。已知:


则 与NO反应的热化学方程式
与NO反应的热化学方程式 的
的 =
=_______ kJ/mol(用含a、b的代数式表示)。
(2)已知 的反应历程分两步:
的反应历程分两步:
I. (快平衡)
(快平衡)
Ⅱ. (慢反应)
(慢反应)
决定NO氧化反应速率的步骤是_______ (填“I”或“Ⅱ”)。用 表示的速率方程为
表示的速率方程为 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数(与温度有关),则
分别表示速率常数(与温度有关),则 与
与 的关系为
的关系为_______ 。
(3)将0.2molNO(g)、0.1 (g)和0.2molHe(g)通入反应器,在温度T、压强
(g)和0.2molHe(g)通入反应器,在温度T、压强 条件下进行反应
条件下进行反应 和
和 (g)。tmin时达到化学平衡,NO的转化率为60%,且
(g)。tmin时达到化学平衡,NO的转化率为60%,且 与
与 的物质的量相等,则v
的物质的量相等,则v =
=_______  。该温度时,反应
。该温度时,反应 的平衡常数
的平衡常数
_______  (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。
(4)利用 与
与 反应构成电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示:
反应构成电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示:

①电极B的电极反应式为_______ 。
②当有2.4mol 通过阴离子交换膜时,理论上生成
通过阴离子交换膜时,理论上生成 的体积为
的体积为_______ (标准状况)。
(1)①在恒温恒容的密闭容器中充入1mol
A.
C.气体的密度不再改变 D.容器内气体的平均摩尔质量不变
②以
则
(2)已知
I.
Ⅱ.
决定NO氧化反应速率的步骤是
(3)将0.2molNO(g)、0.1
(4)利用

①电极B的电极反应式为
②当有2.4mol
2024·云南曲靖·一模
类题推荐
丙烯腈主要用于制造聚丙烯腈、丁腈橡胶、染料、合成树脂、医药等。以氨、丙烯、氧气为原料,在催化剂存在下生成丙烯腈 和副产物丙烯醛
和副产物丙烯醛 的热化学方程式如下:
的热化学方程式如下:
主反应:
 ;
;
副反应:
 。
。
(1)一定条件下,若容器内只发生主反应,在1L恒容密闭容器中通入 、
、 、
、 ,丙烯腈的产率与温度的关系如图所示。
,丙烯腈的产率与温度的关系如图所示。

①
________ 0(填“>”或“<”)。
②若该反应达到A点所需的时间为tmin,则理论上 的平均反应速率为
的平均反应速率为________ 。
(2)恒温恒容条件下,若容器内只发生主反应,下列选项表明反应一定已经达平衡状态的是________(填字母)。
(3)恒温时若容器内主反应、副反应同时发生,达到平衡后压缩容器体积,副反应的平衡移动方向为________ 。(填“正向移动”“逆向移动”或“不移动”)。
(4)已知对于反应: ,其标准平衡常数:
,其标准平衡常数: 。T℃,压强为
。T℃,压强为 的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气同时发生主反应、副反应,达到平衡时容器内有
的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气同时发生主反应、副反应,达到平衡时容器内有 ,
, ,此时丙烯的分压
,此时丙烯的分压
________ (分压=总压 物质的量分数,用含a,b的代数式表示,下同);副反应的标准平衡常数为
物质的量分数,用含a,b的代数式表示,下同);副反应的标准平衡常数为________ 。
(5)用丙烯腈 电合成已二腈
电合成已二腈 的原理如图:
的原理如图:
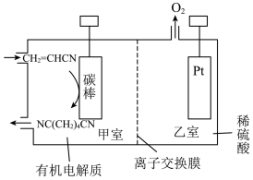
阴极的电极反应式为________ ;工作时乙室的pH________ (填“增大”“减小”或“不变”)
主反应:
副反应:
(1)一定条件下,若容器内只发生主反应,在1L恒容密闭容器中通入

①
②若该反应达到A点所需的时间为tmin,则理论上
(2)恒温恒容条件下,若容器内只发生主反应,下列选项表明反应一定已经达平衡状态的是________(填字母)。
| A.容器内 | B.容器内混合气体的平均摩尔质量不再变化 |
| C.化学平衡常数保持不变 | D. |
(4)已知对于反应:
(5)用丙烯腈

阴极的电极反应式为
处理、回收利用CO是环境科学研究的热点课题。回答下列问题:
(1)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g) CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
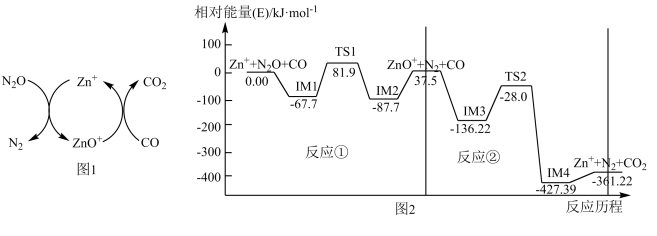
总反应:CO(g)+N2O(g) CO2(g)+N2(g) ΔH=
CO2(g)+N2(g) ΔH=_______ kJ·mol-1;该总反应的决速步是反应_______ (填“①”或“②”),该判断的理由是_______
(2)已知:CO(g)+N2O(g) CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是_______(填字母序号)。
CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是_______(填字母序号)。
(3)在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与 、在
、在 =1时N2O的转化率与
=1时N2O的转化率与 的变化曲线如图3所示:
的变化曲线如图3所示:

①表示N2O的转化率随 的变化曲线为
的变化曲线为_______ 曲线(填“I”或“Ⅱ”);
②T1_______ T2(填“>”或“<”);
③已知:该反应的标准平衡常数 ,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=_______ (计算结果保留两位有效数字,P分=P总×物质的量分数)。
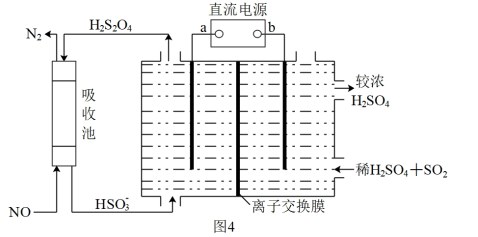
(4)氮的氧化物脱除可用电化学原理处理,如图4装置可同时吸收SO2和NO。已知:H2S2O4是一种弱酸。直流电源的负极为_______ ( 填“a”或“b”),阴极的电极反应式_______ 。
(1)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g)

总反应:CO(g)+N2O(g)
(2)已知:CO(g)+N2O(g)
| A.升温 | B.恒容时,再充入CO | C.恒压时,再充入N2O | D.恒压时,再充入N2 |

①表示N2O的转化率随
②T1
③已知:该反应的标准平衡常数
(4)氮的氧化物脱除可用电化学原理处理,如图4装置可同时吸收SO2和NO。已知:H2S2O4是一种弱酸。直流电源的负极为

为减少CO2排放、科学家着眼于能源转换和再利用等问题。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
①已知部分共价键键能如表。
则反应CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)的∆H=_______ kJ•mol-1。
②向刚性绝热密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是_______ (填编号)。
A.容器内温度不变 B.混合气体平均密度保持不变
C.CH4的体积分数保持不变 D.v正(CO2)=v逆(H2O)
(2)CO2与H2在某催化剂表面制甲醇的化学方程式是:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ∆H<0。
①320℃时,CO2与H2按体积比1:4投入到刚性密闭容器中,同时加入催化剂发生合成甲醇的反应,测得初始时压强为p,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为_______ 。
②若将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。图甲表示压强为0.1 MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。
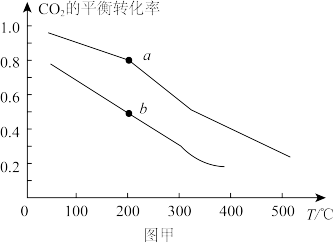
a、b两点正反应速率分别用va、vb表示,则va_______ vb(填“大于”、“小于”或“等于”)。
b点对应的平衡常数Kp=_______ MPa-2(Kp为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。
(3)我国科学家用S-In催化剂电催化还原CO2制甲酸的机理如图乙所示,其中吸附在催化剂表面的原子用*标注。
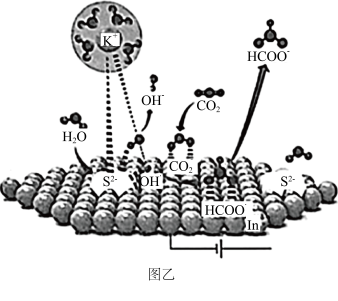
①图乙中,催化剂S2-活性位点在催化过程中的作用是_______ 。
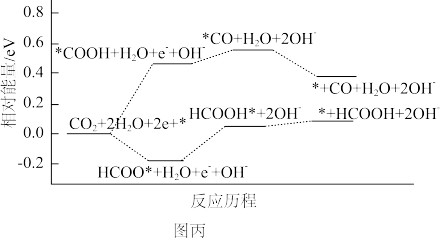
②图丙为催化还原CO2的反应历程图。其中,生成甲酸的决速步骤的电极反应式为_______ ,从反应能垒角度分析该催化剂对生成甲酸具有高选择性的原因:_______ 。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
①已知部分共价键键能如表。
| 化学键 | C=O | C-H | H-H | H-O |
| 键能/kJ•mol-1 | 745.0 | 413.4 | 436.0 | 462.8 |
②向刚性绝热密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是
A.容器内温度不变 B.混合气体平均密度保持不变
C.CH4的体积分数保持不变 D.v正(CO2)=v逆(H2O)
(2)CO2与H2在某催化剂表面制甲醇的化学方程式是:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ∆H<0。
①320℃时,CO2与H2按体积比1:4投入到刚性密闭容器中,同时加入催化剂发生合成甲醇的反应,测得初始时压强为p,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为
②若将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。图甲表示压强为0.1 MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。

a、b两点正反应速率分别用va、vb表示,则va
b点对应的平衡常数Kp=
(3)我国科学家用S-In催化剂电催化还原CO2制甲酸的机理如图乙所示,其中吸附在催化剂表面的原子用*标注。

①图乙中,催化剂S2-活性位点在催化过程中的作用是
②图丙为催化还原CO2的反应历程图。其中,生成甲酸的决速步骤的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


