解答题-原理综合题 适中0.65 引用1 组卷99
合成氨原料气高纯氢可以由天然气、水蒸气催化重整制取,所涉及的主要反应如下:
已知:反应 的物质的量分数平衡常数
的物质的量分数平衡常数 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
CH4(g)的相对能量为_____ kJ·mol-l。
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.
Ⅱ._____ 。
Ⅲ.
Ⅳ.
V.
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值( )
)_____ (填“增大”“减小”或“不变”),其原因为_____ 。
(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为_____ 。
②T℃时,反应i的平衡常数Kx1=_____ (列出表达式,无需化简)。
③若将容器的体积压缩为1L,甲烷的平衡转化率_____ (填“增大”“减小”或“不变”,下同),反应ⅲ的逆反应速率_____ 。
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是_____ (填字母)。
A.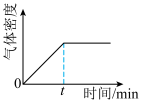 B.
B.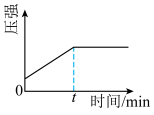 C.
C.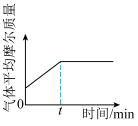 D.
D.
| 相关反应 | △H | 物质的量分数平衡常数 | |
| 反应i | Kx1 | ||
| 反应ⅱ | Kx2 | ||
| 反应iii | Kx3 |
请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
| 物质 | CO(g) | H2O(g) | H2(g) |
| 相对能量/(kJ·mol-1) | -110.5 | -241.8 | 0 |
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.
Ⅱ.
Ⅲ.
Ⅳ.
V.
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(
(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为
②T℃时,反应i的平衡常数Kx1=
③若将容器的体积压缩为1L,甲烷的平衡转化率
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是
A.
 B.
B. C.
C. D.
D.
23-24高三下·河南·阶段练习
类题推荐
研究碳及其化合物的资源化利用具有重要的意义。回答下列问题:
(1)已知下列热化学方程式:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
则反应CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH3=
CO(g)+3H2(g)的ΔH3=_______ kJ/mol。
(2)在T°C时,将1molCO2和3molH2加入容积不变的密闭容器中,发生反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g),实验测得CO2的体积分数φ(CO2)如表所示:
CH4(g)+2H2O(g),实验测得CO2的体积分数φ(CO2)如表所示:
①能判断反应CO2(g)+4H2(g) CH4(g)+2H2O(g)达到平衡的是
CH4(g)+2H2O(g)达到平衡的是_______ (填标号)。
A.CO2的消耗速率和CH4的生成速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
D.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO2的转化率为_______ %(结果保留三位有效数字)。
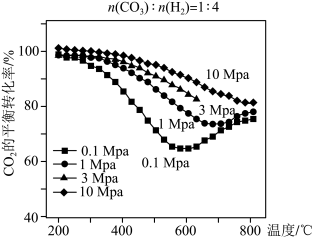
(3)将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600°C之后,随温度升高而增大的主要原因是_______ 。
(4)在T°C时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g) =HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始
=HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始 的关系如图所示:(分压=总压×物质的量分数)
的关系如图所示:(分压=总压×物质的量分数)

①起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)=_______ mol/(L·min)。
②b点时反应的平衡常数Kp=_______ (kPa)-1(以分压表示)。
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率_______ (填“增大”“不变”或减小”)。
(1)已知下列热化学方程式:
反应I:CO2(g)+4H2(g)
反应II:CO2(g)+H2(g)
则反应CH4(g)+H2O(g)
(2)在T°C时,将1molCO2和3molH2加入容积不变的密闭容器中,发生反应I:CO2(g)+4H2(g)
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(CO2) | 0.25 | 0.23 | 0.214 | 0.202 | 0.200 | 0.200 |
A.CO2的消耗速率和CH4的生成速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
D.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO2的转化率为
(3)将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600°C之后,随温度升高而增大的主要原因是

(4)在T°C时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g)

①起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)=
②b点时反应的平衡常数Kp=
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网