解答题-实验探究题 较难0.4 引用2 组卷228
NH4CuSO3(亚硫酸亚铜铵)是一种白色难溶于水、难溶于酒精的化工产品。某小组设计如下实验装置制备NH4CuSO3并探究SO2的漂白性。
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
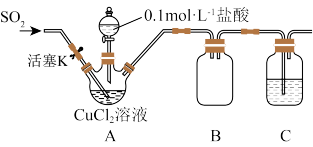
(1)检查装置A气密性的操作方法为_____ 。
(2)装置C的目的是_____ 。
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为_____ 。
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是_____ 。
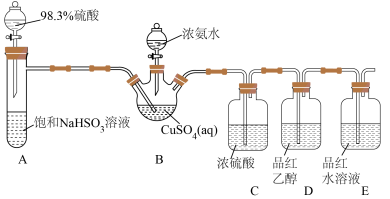
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是 ;
;
猜想ⅱ:乙同学认为使品红褪色的微粒主要是 ;。
;。
为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的_____ 溶液(填化学式,下同)和0.1mol·L-1_____ 溶液,发现前者褪色快,后者褪色慢,说明上述猜想i比ⅱ合理。
(6)测定产品中 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是_____ %(结果保留三位有效数字)。下列操作使测得的NH4CuSO3质量分数偏大的为_____ (填字母)。
a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
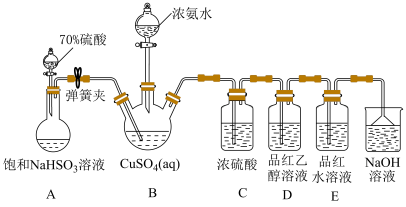
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为
(2)装置C的目的是
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是
猜想ⅱ:乙同学认为使品红褪色的微粒主要是
为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的
(6)测定产品中
a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
23-24高三下·河南·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网