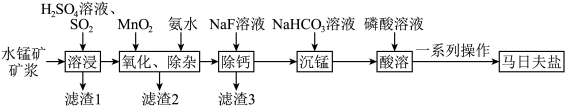
解答题-工业流程题 较难0.4 引用1 组卷395
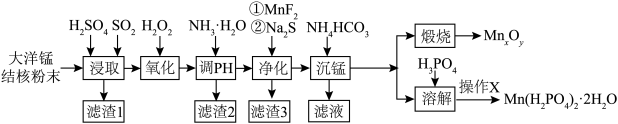
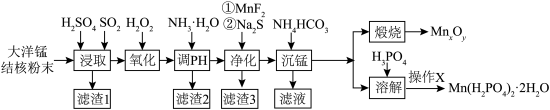
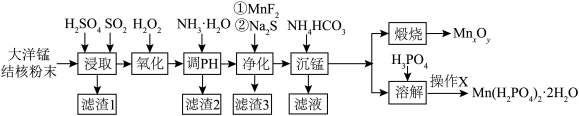
以大洋锰结核(主要由MnO2和铁氧化物组成,还含有Al、Mg、Zn、Ca、Si等元素)为原料,制备MnxOy及Mn(H2PO4)2·2H2O,所得产品具有广泛的用途。制备过程如下图所示:
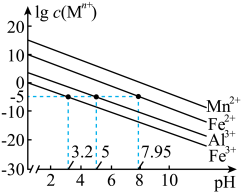
已知:①金属离子浓度≤10-5mol/L时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如下:
②25℃时,Ksp(ZnS)=2.9×10-25;Ksp(MnF2)=5.3×10-3;Ksp(MgF2)=7.4×10-11;Ksp(MnCO3)=1.0×10-11。
(1)基态锰原子的价层电子轨道表示式为___________ 。
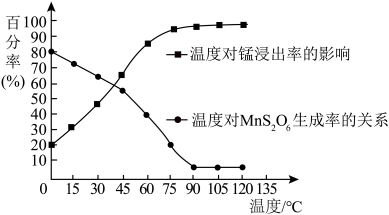
(2)“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式___________ 。温度对锰的浸出率、MnS2O6生成率的影响如图所示,为了减少副产物的生成,最适宜的温度___________ 。
(3)“调pH”时,应控制的pH范围是___________ 。“净化”后滤渣3的主要成分___________ 。
(4)“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为___________ 。若改用加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)  Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = ___________ (填数值)。
(5)要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为___________ 、过滤、洗涤、干燥。
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
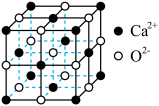
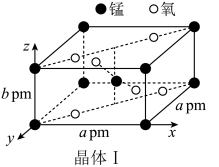
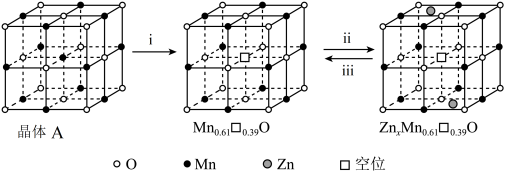
①晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。阿伏伽德罗常数为NA mol-1,则晶体Ⅰ的密度为___________ g·cm-3。
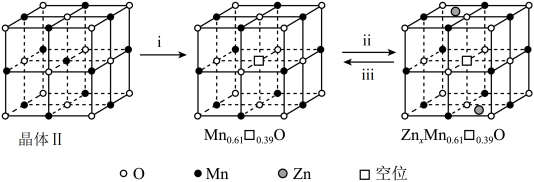
②晶体Ⅱ可作电池正极材料,通过Zn2+在晶体Ⅱ中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“ii”代表电池___________ (填“充电”或“放电”)过程,“iii”的电极反应式为___________ 。

已知:①金属离子浓度≤10-5mol/L时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
(1)基态锰原子的价层电子轨道表示式为
(2)“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式

(3)“调pH”时,应控制的pH范围是
(4)“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为
(5)要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
①晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。阿伏伽德罗常数为NA mol-1,则晶体Ⅰ的密度为

②晶体Ⅱ可作电池正极材料,通过Zn2+在晶体Ⅱ中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“ii”代表电池

2024·福建龙岩·一模
类题推荐
以大洋锰结核(主要由 和铁氧化物组成,还含有
和铁氧化物组成,还含有 等元素)为原料,制备
等元素)为原料,制备 及
及 ,所得产品具有广泛的用途。制备过程如图所示:
,所得产品具有广泛的用途。制备过程如图所示: 范围如下:
范围如下:
② 时,
时, ;
; ;
; ;
; 。
。
(1)基态 的价电子排布式为
的价电子排布式为___________ 。
(2)“浸取”时,有副产物 生成,请写出该副反应的化学方程式
生成,请写出该副反应的化学方程式___________ 。
(3)“调 ”时,应控制的
”时,应控制的 范围是
范围是___________ 。“净化”后滤渣3的主要成分___________ 。
(4)要将“溶解”后的溶液制得 晶体,操作X为
晶体,操作X为___________ 、过滤、洗涤、干燥。
(5)将“沉锰”后得到的 煅烧得到固体产物,其固体产物的晶胞(立方体结构)如下晶体A所示。经测定,该晶胞中最近两个
煅烧得到固体产物,其固体产物的晶胞(立方体结构)如下晶体A所示。经测定,该晶胞中最近两个 的距离为
的距离为 。则该固体产物的密度为
。则该固体产物的密度为___________  。(设
。(设 为阿伏加德罗常数,用含x和
为阿伏加德罗常数,用含x和 的代数式表示)
的代数式表示)
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。晶体A可作电池正极材料,通过 晶体A中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“iii”的电极反应式为
晶体A中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“iii”的电极反应式为___________ 。
| 金属离子 | ||||||
| 开始沉淀时的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
| 沉淀完全时的 | 10.0 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
(1)基态
(2)“浸取”时,有副产物
(3)“调
(4)要将“溶解”后的溶液制得
(5)将“沉锰”后得到的
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。晶体A可作电池正极材料,通过
以大洋锰结核(主要由 和铁氧化物组成,还含有
和铁氧化物组成,还含有 等元素)为原料,制备
等元素)为原料,制备 及
及 ,所得产品具有广泛的用途。制备过程如图所示:
,所得产品具有广泛的用途。制备过程如图所示: 范围如下:
范围如下:
② 时,
时, 。
。
(1)基态锰原子的价层电子轨道表示式为___________ 。
(2)“浸取”时,有副产物 生成,请写出该副反应的化学方程式
生成,请写出该副反应的化学方程式___________ 。
(3)“调 ”时,应控制的
”时,应控制的 范围是
范围是___________ 。“净化”后滤渣3的主要成分___________ 。
(4)“沉锰”时,加入过量 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为___________ 。
(5)要将“溶解”后的溶液制得 晶体,操作
晶体,操作 为
为___________ 、过滤、洗涤、干燥。
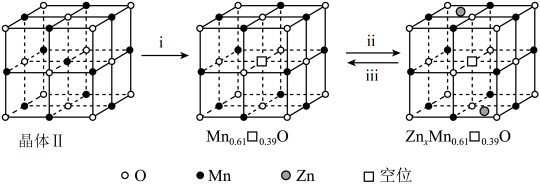
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。晶体1可作电池正极材料,通过 晶体Ⅰ中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“ⅱ”代表电池
晶体Ⅰ中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“ⅱ”代表电池___________ (填“充电”或“放电”)过程,“ⅲ”的电极反应式为___________ 。
(7)
| 金属离子 | ||||||
| 开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
| 沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
(1)基态锰原子的价层电子轨道表示式为
(2)“浸取”时,有副产物
(3)“调
(4)“沉锰”时,加入过量
(5)要将“溶解”后的溶液制得
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。晶体1可作电池正极材料,通过
(7)
(8)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网