解答题-实验探究题 较难0.4 引用1 组卷168
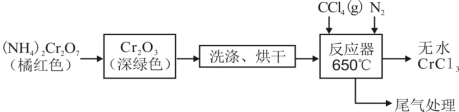
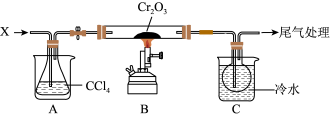
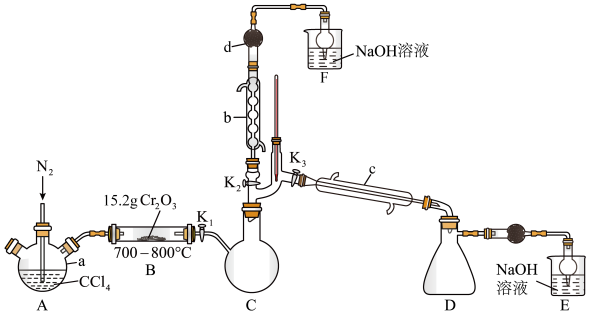
三氯化铬(CrCl3)为紫色单斜晶体,熔点为83 ℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。在实验室中利用Cr2O3与CCl4反应制备无水CrCl3,并收集该反应产生的光气(COCl2),实验装置如图所示(夹持、加热及部分冷却装置已省略)。
实验步骤如下:

Ⅰ.检查完装置气密性后,按照图示装入药品,打开K1、K2、K3,通入氮气。
Ⅱ.一段时间后,关闭K3,将装置B加热到预定温度,再将装置A在85 ℃下进行水浴加热。
Ⅲ.待装置B中反应结束后,装置A、B停止加热;一段时间后,停止通入氮气。
Ⅳ.将装置C在30 ℃下进行加热,得到产物和光气。
已知:ⅰ.光气能溶于CCl4,易与水发生反应生成CO2和HCl。
ⅱ.有关物质的熔、沸点如下表:
回答下列问题:
(1)仪器d中盛有无水CaCl2固体,其作用为___________ ;若无仪器d和后续装置,仪器b的上管口可能出现的现象为___________ 。
(2)通入N2除起到将装置内空气排出的作用外,还具有的作用为___________ (写一条即可)。
(3)步骤Ⅳ中,将光气分离出的操作名称为___________ ;
(4)B中得到产品的化学方程式为___________ 。
(5)光气剧毒,该实验中用NaOH溶液吸收逸出的少量光气。也可以用乙醇处理COCl2,生成一种含氧酸酯(C2H5OCOOC2H5),用乙醇处理光气的化学方程式为___________ 。
(6)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
①该实验可选用的指示剂名称为___________ 。
②样品中无水三氯化铬的质量分数为___________ 。
实验步骤如下:

Ⅰ.检查完装置气密性后,按照图示装入药品,打开K1、K2、K3,通入氮气。
Ⅱ.一段时间后,关闭K3,将装置B加热到预定温度,再将装置A在85 ℃下进行水浴加热。
Ⅲ.待装置B中反应结束后,装置A、B停止加热;一段时间后,停止通入氮气。
Ⅳ.将装置C在30 ℃下进行加热,得到产物和光气。
已知:ⅰ.光气能溶于CCl4,易与水发生反应生成CO2和HCl。
ⅱ.有关物质的熔、沸点如下表:
| 化学式 | Cr2O3 | CrCl3 | CCl4 | COCl2 |
| 熔点/℃ | 1435 | 1 152 | -23 | -118 |
| 沸点/℃ | 4000 | 1 300 | 76 | 8.2 |
(1)仪器d中盛有无水CaCl2固体,其作用为
(2)通入N2除起到将装置内空气排出的作用外,还具有的作用为
(3)步骤Ⅳ中,将光气分离出的操作名称为
(4)B中得到产品的化学方程式为
(5)光气剧毒,该实验中用NaOH溶液吸收逸出的少量光气。也可以用乙醇处理COCl2,生成一种含氧酸酯(C2H5OCOOC2H5),用乙醇处理光气的化学方程式为
(6)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O
已知:Cr2O
①该实验可选用的指示剂名称为
②样品中无水三氯化铬的质量分数为
2024·宁夏银川·一模
类题推荐
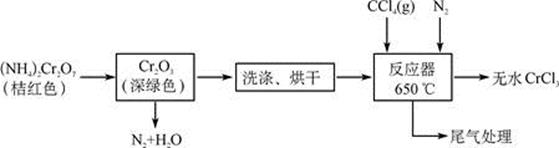
某小组查阅有关资料后,在实验室中利用Cr2O3和CCl4反应制备无水CrCl3,并收集该反应产生的光气(COCl2),实验装置如图所示(夹持、加热及部分冷却装置已省略)。
Ⅰ.检查完装置气密性后,按照图示装入药品,打开K1、K2、K3,通入氮气;
Ⅱ.一段时间后,关闭K3,将装置B加热到预定温度,再将装置A在85°C下进行水浴加热;
Ⅲ.待装置B中反应结束后,装置A、B停止加热;一段时间后,停止通入氮气;
Ⅳ.将装置C在30°C下进行加热,得到产物光气;
Ⅴ.实验结束后,称量装置B中剩余固体质量为28.4 g。
已知:
i.光气能溶于CCl4,易与水发生反应生成CO2和HCl。
ii.有关物质的熔沸点如下表:
回答下列问题:
(1)仪器a的名称为__________ ;仪器d中盛有无水CaCl2固体,其作用为___________ ,若无仪器d和后续装置,仪器b的上管口可能出现的现象为_________________ 。
(2)通入N2除起到将装置内空气排出外,还具有的作用为___________ (至少写一条)。
(3)步骤Ⅳ中,将光气分离出的操作名称为______________ ;加热方式为________________ ;加热时K1、K2、K3的状态为_____________________ 。
(4)仪器b和仪器c均为冷凝管,但在实验中不能互换位置,原因为___________________ 。
(5)B中得到产品的化学方程式为_____________________________ 。
(6)本实验中CrCl3的产率为__________ 。
Ⅰ.检查完装置气密性后,按照图示装入药品,打开K1、K2、K3,通入氮气;
Ⅱ.一段时间后,关闭K3,将装置B加热到预定温度,再将装置A在85°C下进行水浴加热;
Ⅲ.待装置B中反应结束后,装置A、B停止加热;一段时间后,停止通入氮气;
Ⅳ.将装置C在30°C下进行加热,得到产物光气;
Ⅴ.实验结束后,称量装置B中剩余固体质量为28.4 g。
已知:
i.光气能溶于CCl4,易与水发生反应生成CO2和HCl。
ii.有关物质的熔沸点如下表:
化学式 | Cr2O3 | CrCl3 | CCl4 | COCl2 |
熔点/°C | 1435 | 1152 | -23 | -118 |
沸点/°C | 4000 | 1300 | 76 | 8.2 |
(1)仪器a的名称为
(2)通入N2除起到将装置内空气排出外,还具有的作用为
(3)步骤Ⅳ中,将光气分离出的操作名称为
(4)仪器b和仪器c均为冷凝管,但在实验中不能互换位置,原因为
(5)B中得到产品的化学方程式为
(6)本实验中CrCl3的产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网