解答题-原理综合题 适中0.65 引用2 组卷218
羰基硫(COS)作为一种粮食熏蒸剂广泛应用于农药工业。利用工厂废气中的H2S和CO反应可以合成COS,回答下列问题:
(1)已知:①CO的燃烧热为283kJ•mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ•mol-1
③COS(g)+H2O(g) H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
④CO(g)+H2S(g) COS(g)+H2(g) ΔH3
COS(g)+H2(g) ΔH3
则ΔH3=_______ kJ•mol-1。
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是_______ (填“甲”或“乙”)。
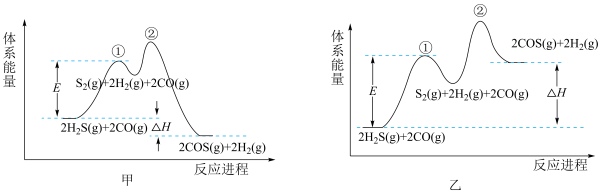
关于该反应的下列叙述正确的是_______ (填标号)。
A.步骤①是慢反应,活化能较大 B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物 D.更换催化剂可改变E和ΔH
(3)在240℃,将等物质的量H2S和CO充入恒压(100kPa)的密闭容器中发生反应:CO(g)+H2S(g) COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆=
COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆= kPa-1•s-1测得,则H2S的转化率为
kPa-1•s-1测得,则H2S的转化率为______ ,COS的体积分数为______ 。在240℃下,要同时提高CO和H2S的转化率,可采取的措施是______ 。
(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)=φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t)的变化关系如图所示。

320℃时,φ(COS)随时间变化关系的曲线是______ ,判断的理由是_______ 。
(1)已知:①CO的燃烧热为283kJ•mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ•mol-1
③COS(g)+H2O(g)
④CO(g)+H2S(g)
则ΔH3=
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是

关于该反应的下列叙述正确的是
A.步骤①是慢反应,活化能较大 B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物 D.更换催化剂可改变E和ΔH
(3)在240℃,将等物质的量H2S和CO充入恒压(100kPa)的密闭容器中发生反应:CO(g)+H2S(g)
(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)=φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t)的变化关系如图所示。

320℃时,φ(COS)随时间变化关系的曲线是
2024·四川·二模
类题推荐
合成氨工业在国民生产中有重要意义,以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) △H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量0.2mol。则前5分钟的平均反应速率v(N2)=
2NH3(g) △H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量0.2mol。则前5分钟的平均反应速率v(N2)=____ 。平衡时H2的转化率为____ 。
(2)平衡后,若要提高H2的转化率,可以采取的措施有____ 。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1____ K2(填“<”、“>”或“=”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____ 。(填序号字母)。
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为____ 。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正____ v(N2)逆(填“<”“>”或“=”)。
(4)反应CO(g)+2H2(g)=CH3OH(g) △H<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
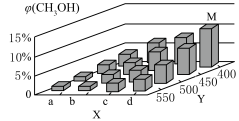
①平衡时,M点CH3OH的体积分数为10%,CO的转化率为____ 。
②X轴上a点的数值比b点____ (填“大”“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是_____ 。
用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(5)已知:2SO2(g)+O2(g) 2SO3(g) △H1
2SO3(g) △H1
2NO(g)+O2(g) 2NO2(g) △H2
2NO2(g) △H2
NO2(g)+SO2(g)=SO3(g)+NO(g) △H3
则△H3=____ (用△H1、△H2表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=____ (用K1、K2表示)。
(6)如图所示,甲是恒容的密闭容器,乙是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2molNO和1molO2通过K1、K3分别充入甲、乙中,发生的反应为2NO(g)+O2(g) 2NO2(g)[不考虑2NO2(g)
2NO2(g)[不考虑2NO2(g) N2O4(g)],起始时甲、乙的体积相同均为aL。
N2O4(g)],起始时甲、乙的体积相同均为aL。
①下列说法正确的是_____ 。
a.甲、乙两容器中气体的颜色均不再发生变化,说明两容器中的反应已达平衡状态
b.甲、乙两容器中NO和O2物质的量浓度比均为2:1时,说明两容器中的反应已达平衡状态
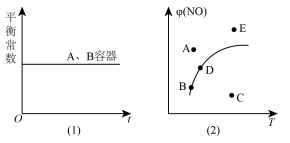
c.甲、乙两容器中平衡常数随时间变化如图(1)所示
d.在其它条件一定时,图(2)中曲线表示反应2NO(g)+O2(g) 2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且v正>v逆的点是A或E
2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且v正>v逆的点是A或E
②T℃时,甲容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1。若A容器中反应达到平衡时p(NO2)=200kPa,则平衡时NO的转化率为____ 。(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)
(2)平衡后,若要提高H2的转化率,可以采取的措施有
| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)
(4)反应CO(g)+2H2(g)=CH3OH(g) △H<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,CO的转化率为
②X轴上a点的数值比b点
用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(5)已知:2SO2(g)+O2(g)
2NO(g)+O2(g)
NO2(g)+SO2(g)=SO3(g)+NO(g) △H3
则△H3=
(6)如图所示,甲是恒容的密闭容器,乙是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2molNO和1molO2通过K1、K3分别充入甲、乙中,发生的反应为2NO(g)+O2(g)

①下列说法正确的是

a.甲、乙两容器中气体的颜色均不再发生变化,说明两容器中的反应已达平衡状态
b.甲、乙两容器中NO和O2物质的量浓度比均为2:1时,说明两容器中的反应已达平衡状态
c.甲、乙两容器中平衡常数随时间变化如图(1)所示
d.在其它条件一定时,图(2)中曲线表示反应2NO(g)+O2(g)
②T℃时,甲容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1。若A容器中反应达到平衡时p(NO2)=200kPa,则平衡时NO的转化率为
1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g) CH2ClCHClCH3(g) ∆H1=-134kJ·mol-1
CH2ClCHClCH3(g) ∆H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) ∆H2=-102kJ·mol-1
CH2=CHCH2Cl(g)+HCl(g) ∆H2=-102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g) CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________ kJ·mol-1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________ (填“增大”“减小”或“不变”),理由是_________________________________ 。
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强_________________ (填“增大”“减小”或“不变”)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,_________ 填“是”或“否”)判断理由是_______________________ 。

(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
①用单位时间内气体分压的变化来表示反应速率,即 ,则前120min内平均反应速率v(CH2ClCHClCH3)=
,则前120min内平均反应速率v(CH2ClCHClCH3)=__________ kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HCl的体积分数为 ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率
____________ ;反应I的平衡常数Kp=____________________ kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
I.CH2=CHCH3(g)+Cl2(g)
II.CH2=CHCH3(g)+Cl2(g)
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,

(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
②该温度下,若平衡时HCl的体积分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网