解答题-原理综合题 适中0.65 引用1 组卷38
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是_______ 。
②若起始时向容器内放入2molN2和6molH2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)_______ 184.4kJ。
③已知:

1molN-H键断裂吸收的能量等于_______ kJ。
④理论上,为了增大平衡时H2的转化率,可采取的措施是_______ (填序号)。
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的 恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
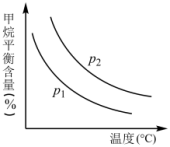
上图中两条曲线表示的压强的关系是:P1_______ P2(填“>”“=”或“<”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为_______ 。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_______ (填序号)。
a.混合气体的平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中P(CO)、P(H2O)不随时间改变
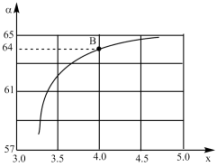
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(1),在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,下图是氨碳比(x)与CO2平衡转化率(α:%)的关系。下图中的B点处,NH3的平衡转化率为
=x,下图是氨碳比(x)与CO2平衡转化率(α:%)的关系。下图中的B点处,NH3的平衡转化率为_______ 。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是
②若起始时向容器内放入2molN2和6molH2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)
③已知:

1molN-H键断裂吸收的能量等于
④理论上,为了增大平衡时H2的转化率,可采取的措施是
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的

上图中两条曲线表示的压强的关系是:P1
(3)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a.混合气体的平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中P(CO)、P(H2O)不随时间改变
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(1),在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)

23-24高二上·四川达州·期中
类题推荐
合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g)⇌2NH3(g)的化学平衡常数表达式为_______ 。
(2)对于反应N2(g)+3H2(g)⇌2NH3(g),在一定条件下氨的平衡含量如下表。
①该反应为_______ (填“吸热”或“放热”)反应。
②其他条件不变时,温度升高氨的平衡含量减小的原因是_______ (填字母序号)。
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
(3)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率_______ (填“变大”“变小”或“不变”)。
(4)原料气H2可通过反应 CH4(g)+H2O(g)⇌CO(g) + 3H2(g)获取,已知该反应中当初始混合气中的 恒定时,温度、压强对平衡混合气CH4含量的影响如下图:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图:
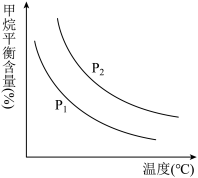
①图中,两条曲线表示压强的关系是:P1_______ P2(填“>”、“=”或“<”)。
②该反应为_______ 反应(填“吸热”或“放热”)。
(5)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为_______ ,该温度下反应的平衡常数K值为_______ 。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_______ (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(1)反应N2(g)+3H2(g)⇌2NH3(g)的化学平衡常数表达式为
(2)对于反应N2(g)+3H2(g)⇌2NH3(g),在一定条件下氨的平衡含量如下表。
| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②其他条件不变时,温度升高氨的平衡含量减小的原因是
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
(3)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率
(4)原料气H2可通过反应 CH4(g)+H2O(g)⇌CO(g) + 3H2(g)获取,已知该反应中当初始混合气中的

①图中,两条曲线表示压强的关系是:P1
②该反应为
(5)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2⇌2NH3的平衡常数K值和温度的关系如下:
(1)①由表中数据可知该反应为放热反应,理由是_______ 。
②理论上,为了增大平衡时H2的转化率,可采取的措施是_______ (填字母序号)。
a.增大压强 b.使用合适的催化剂 c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的 恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
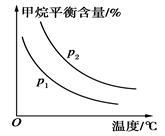
①图中,两条曲线表示压强的关系是p1_______ p2(填“>”、“=”或“<”)。
②该反应为_______ 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2 (g)获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为_______ 该温度下反应的平衡常数K值为_______ 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5 L的容器中进行反应,下列描述能够说明体系处于平衡状态的是_______ (填字母序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
| 温度/℃ | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①由表中数据可知该反应为放热反应,理由是
②理论上,为了增大平衡时H2的转化率,可采取的措施是
a.增大压强 b.使用合适的催化剂 c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的

①图中,两条曲线表示压强的关系是p1
②该反应为
(3)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2 (g)获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5 L的容器中进行反应,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
(1)①由上表数据可知该反应为____ 反应(填“放热”或“吸热”或“无法确定”)。
②下列措施能用勒夏特列原理解释是____ (填序号)。
a.增大压强有利于合成氨
b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500℃左右
d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液恰好完全反应放热QkJ,写出该反应的热化学方程式(溶液用aq表示):____ 。
(3)已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ)
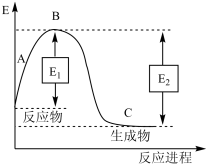
根据以上键能数据计算N-H键的键能为____ kJ·mol-1。
(4)原料气H2可通过反应CH4(g)+H2O(g) CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的甲烷与水蒸气的物质的量之比恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的甲烷与水蒸气的物质的量之比恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
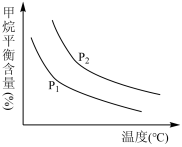
①图中,两条曲线表示压强的关系是:P1____ P2(填“>”或“=”或“<”)。
②其它条件一定,升高温度,CH4的转化率会_____ (填“增大”或“减小”或“不变”)。
(5)原料气H2还可通过反应CO(g)+H2O(g) CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol/L,该温度下反应的平衡常数K值为____ 。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是____ (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
| 温度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②下列措施能用勒夏特列原理解释是
a.增大压强有利于合成氨
b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500℃左右
d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液恰好完全反应放热QkJ,写出该反应的热化学方程式(溶液用aq表示):
(3)已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ)

| 化学键 | H-H | N≡N |
| 键能(kJ·mol-1) | 436 | 946 |
(4)原料气H2可通过反应CH4(g)+H2O(g)

①图中,两条曲线表示压强的关系是:P1
②其它条件一定,升高温度,CH4的转化率会
(5)原料气H2还可通过反应CO(g)+H2O(g)
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol/L,该温度下反应的平衡常数K值为
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


