解答题-工业流程题 适中0.65 引用2 组卷111
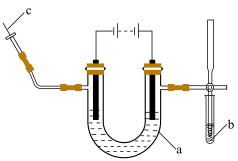
Ⅰ.海水中的氯化钠被提纯和精制后,可通过电解饱和食盐水制取氯气、氢气和氢氧化钠。实验室电解饱和食盐水所用装置如下图所示:___________ 。
A.试管 B.离心试管 C.U形管 D.Y形试管
②在a的两端滴加酚酞试液,通电后左边电极周围出现红色,写出该电极的电极反应式说明溶液变红的原因___________ 。
(2)通电后试管b中淀粉KI溶液由无色变为蓝色,结合离子方程式说明变化原因。___________ 。
(3)c处出来的气体可以点燃,其燃烧的现象是___________ 。
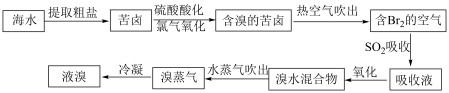
Ⅱ.地球上99%的溴元素分布在海洋中。空气吹出法工艺是目前“海水提溴”的主要方法之一,工艺流程如下图所示:
(5)上述流程中热空气吹出已经得到了粗溴,为什么还要添加“SO2吸收、氧化、水蒸气吹出”三个步骤,其目的是___________ 。
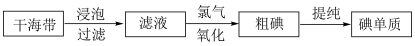
Ⅲ.海洋中的海带等海藻类植物具有富集碘的能力,工业上获取碘的主要流程如下图所示:
Ⅳ.硫元素和氮元素也存在于海洋中。
(7) 是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是
是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是___________ 。
(8)氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环起始于氮的固定,过程可用下图表示。下列关于海洋氮循环的说法正确的是___________。
(9)N、O、S三种元素第一电离能由大到小的顺序为___________ 。
A.O > S > N B.S > N > O C.N > O > S D.O > N > S
A.试管 B.离心试管 C.U形管 D.Y形试管
②在a的两端滴加酚酞试液,通电后左边电极周围出现红色,写出该电极的电极反应式说明溶液变红的原因
(2)通电后试管b中淀粉KI溶液由无色变为蓝色,结合离子方程式说明变化原因。
(3)c处出来的气体可以点燃,其燃烧的现象是
Ⅱ.地球上99%的溴元素分布在海洋中。空气吹出法工艺是目前“海水提溴”的主要方法之一,工艺流程如下图所示:
| A.溴离子的还原性 | B.溴单质的还原性 | C.溴的沸点高 | D.HBr极易溶于水 |
(5)上述流程中热空气吹出已经得到了粗溴,为什么还要添加“SO2吸收、氧化、水蒸气吹出”三个步骤,其目的是
Ⅲ.海洋中的海带等海藻类植物具有富集碘的能力,工业上获取碘的主要流程如下图所示:
| A.酒精 | B.裂化汽油 | C.四氯化碳 | D.乙酸 |
Ⅳ.硫元素和氮元素也存在于海洋中。
(7)
(8)氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环起始于氮的固定,过程可用下图表示。下列关于海洋氮循环的说法正确的是___________。
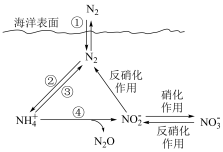
| A.海洋中的氮循环起始于氮的氧化 | B.海洋中的氮循环属于固氮作用的是③ |
| C.海洋中的硝化作用可能有氧气的参与 | D.NH4NO3中只含离子键 |
(9)N、O、S三种元素第一电离能由大到小的顺序为
A.O > S > N B.S > N > O C.N > O > S D.O > N > S
2024·上海宝山·一模
类题推荐
全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。空气吹出法工艺是目前“海水提溴”的最主要方法之一、其工艺流程如图:
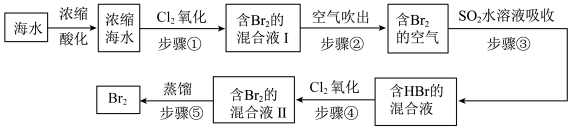
(1)步骤①中获得Br2的离子方程式为____ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收1molBr2共有___ 个电子转移(用NA的代数式表示)。
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤溶解和____ 。
(5)“试剂a”通常应具有一定的____ 性。利用H2O2完成“溶液A”向“溶液B”的转变。写出该反应的化学方程式:________________ 。
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ 。(选填编号)
(7)“操作II”宜选用的装置是 。(选填编号)
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:____ 。
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液50.0mL,恰好反应完全。则所测盐中碘的含量是____ mg•g-1(保留四位小数)。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收1molBr2共有
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤溶解和
(5)“试剂a”通常应具有一定的
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.溴水 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶不与反应 | 与水互溶与I2反应 | 与水不互溶不与I2反应 | 与水不互溶与I2反应 |
(7)“操作II”宜选用的装置是 。(选填编号)
A. | B. | C. | D. |
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液50.0mL,恰好反应完全。则所测盐中碘的含量是
I.溴有“海洋元素”之称,海水中溴含量为65mg•L-1。空气吹出法工艺是目前“海水提溴”的最主要方法之一,其步骤如下:
(1)步骤①中获得Br2的离子方程式为___________ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是___________ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2,共有___________ 个电子转移(用a和 的代数式表示)。
的代数式表示)。
Ⅱ.碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的实验流程如下:___________ 、___________ 。
(5)“试剂a”通常应具有一定的___________ 性。
(6)由于“溶液B”中I2的含量较低,“操作Ⅱ”能将I2 “富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___________ (填试剂标号)。
(7)“操作Ⅱ”宜选用的装置是___________ (填标号)。___________ 。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2,共有
Ⅱ.碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的实验流程如下:

(5)“试剂a”通常应具有一定的
(6)由于“溶液B”中I2的含量较低,“操作Ⅱ”能将I2 “富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶,不与I2反应 | 与水不互溶,不与 I2反应 | 与水不互溶,不与I2反应 | 与水不互溶,与I2反应 |
(7)“操作Ⅱ”宜选用的装置是
我国拥有很长的海岸线,海洋资源的开发利用具有广阔前景。全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。空气吹出法工艺是目前“海水提溴”的最主要方法之一、其工艺流程如图:
(1)步骤①中获得Br2的离子方程式为____ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2共有___ 个电子转移(用a和NA的代数式表示)。
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤:____ 、____ 。
(5)“试剂a”通常应具有一定的____ 性。
利用H2O2完成“溶液A”向“溶液B”的转变。配平该反应的化学方程式:____ 。
______KI+______H2O=______KOH+______I2
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ 。(选填编号)
(7)“操作II”宜选用的装置是____ 。(选填编号)
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:____ 。
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液30.0mL,恰好反应完全。
则所测盐中碘的含量是____ mg•g-1(保留四位小数)。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2共有
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤:
(5)“试剂a”通常应具有一定的
利用H2O2完成“溶液A”向“溶液B”的转变。配平该反应的化学方程式:
______KI+______H2O=______KOH+______I2
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶不与反应 | 与水不互溶不与I2反应 | 与水不互溶不与I2反应 | 与水不互溶与I2反应 |
(7)“操作II”宜选用的装置是
A. | B. | C. | D. |
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液30.0mL,恰好反应完全。
则所测盐中碘的含量是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


