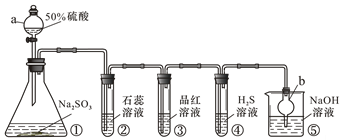解答题-原理综合题 适中0.65 引用1 组卷90
TiO2和TiCl4均为重要的工业原料。已知:

 Ⅰ
Ⅰ

 Ⅱ
Ⅱ
请回答下列问题:
(1) 与
与 反应生成
反应生成 、
、 和氯气的热化学方程式为
和氯气的热化学方程式为___________ ;升高温度对该反应的影响为___________ 。
(2)若反应Ⅱ的逆反应的活化能为 ,则E
,则E___________ (填“>”“<”或“=”)220.9。
(3)t℃时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应Ⅰ。
,发生反应Ⅰ。 时达到平衡,测得
时达到平衡,测得 的物质的量为
的物质的量为 。
。
① 内,用
内,用 表示的反应速率
表示的反应速率
___________ 。
② 的平衡转化率为
的平衡转化率为___________ 。
③该反应的平衡常数为___________ (用分数表示)。
④下列措施,既能加快逆反应速率又能增大 平衡转化率的是
平衡转化率的是___________ (填字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分 D.增大
D.增大 浓度
浓度
(4)实验室各种浓度的硫酸是由浓硫酸稀释而得,
①以下配制过程中各操作的先后顺序是___________ 。
②下列情况会使配制结果偏大的是___________ 。
a.溶解后未冷却即转移、定容
b.定容时仰视容量瓶刻度线
c.用量筒量取一定体积的浓硫酸时俯视
d.将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
请回答下列问题:
(1)
(2)若反应Ⅱ的逆反应的活化能为
(3)t℃时,向
①
②
③该反应的平衡常数为
④下列措施,既能加快逆反应速率又能增大
A.缩小容器容积 B.加入催化剂 C.分离出部分
(4)实验室各种浓度的硫酸是由浓硫酸稀释而得,
①以下配制过程中各操作的先后顺序是

②下列情况会使配制结果偏大的是
a.溶解后未冷却即转移、定容
b.定容时仰视容量瓶刻度线
c.用量筒量取一定体积的浓硫酸时俯视
d.将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
23-24高三下·天津·开学考试
类题推荐
“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ΔH1=-116kJ•mol-1。
(1)已知:CO(g)+ O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+
O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________ 。
(2)下列措施中有利于增大反应:CO(g)+2H2(g) CH3OH(g)的反应速率且利于反应正向进行的是___________。
CH3OH(g)的反应速率且利于反应正向进行的是___________。
(3)恒温条件下,可逆反应:CO(g)+2H2(g) CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是
CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是___________ 。
A.单位时间内生成nmolCH3OH的同时生成2nmolH2
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.CO、H2、CH3OH浓度之比为1:2:1的状态
(4)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
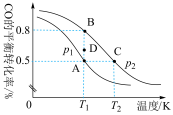
①A、B、C三点平衡常数KA、KB、KC的大小关系是___________ 。
②压强p1___________ p2(填“>”“<”或“=”),若p2=100kPa,则B点的Kp=___________ kPa-2(Kp为以分压表示的平衡常数;分压=总压×物质的量分数)
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:v正___________ v逆(填“>”“<”或“=”)。
(5)在用浓硫酸配制稀硫酸过程中,下列操作中会造成稀硫酸溶液质量分数偏小的是___________(填字母)。
(1)已知:CO(g)+
(2)下列措施中有利于增大反应:CO(g)+2H2(g)
| A.随时将CH3OH与反应混合物分离 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.使用高效催化剂 |
(3)恒温条件下,可逆反应:CO(g)+2H2(g)
A.单位时间内生成nmolCH3OH的同时生成2nmolH2
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.CO、H2、CH3OH浓度之比为1:2:1的状态
(4)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g)

①A、B、C三点平衡常数KA、KB、KC的大小关系是
②压强p1
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:v正
(5)在用浓硫酸配制稀硫酸过程中,下列操作中会造成稀硫酸溶液质量分数偏小的是___________(填字母)。
| A.在稀释时,未恢复至室温就转移入容量瓶 |
| B.在稀释过程中,有少量液体溅出 |
| C.在转移过程中,烧杯和玻璃棒没有进行洗涤 |
| D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线相平 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网