解答题-实验探究题 较难0.4 引用1 组卷137
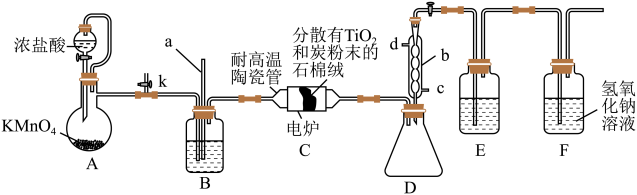
TiCl4是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备(夹持装置略去)。
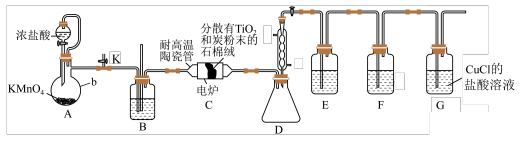
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如表所示:
回答下列问题:
(1)装置B中的试剂是___________ (填试剂名称)。
(2)装置D的作用是___________ ,装置C中除生成 外,还生成CO,该反应的化学方程式为
外,还生成CO,该反应的化学方程式为___________ 。
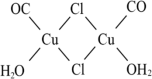
(3)利用G装置可以将CO吸收得到氯化羰基亚铜[Cu2Cl2(CO)2•2H2O],其结构如图所示。试从结构角度分析,CuCl的盐酸溶液可以吸收CO的原因是___________ 。
(4)可以选用下面的一套装置___________(填标号)替换掉装置E和F。
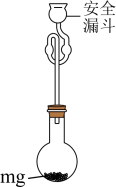
(5)利用如图装置测定所得TiCl4的纯度:取2.0g产品加入烧瓶中,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol•L-1K2CrO4溶液作指示剂,用1.00mol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液40.00mL。已知:常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O=TiO2•nH2O↓+4HCl。
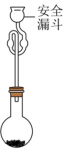
①安全漏斗中的水在本实验中的作用除与TiCl4反应外,还有________ 。
②滴定终点的判断方法是_________ 。
③已知TiCl4的摩尔质量是190g/mol,则产品的纯度为______ (保留两位有效数字)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g•cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
(1)装置B中的试剂是
(2)装置D的作用是
(3)利用G装置可以将CO吸收得到氯化羰基亚铜[Cu2Cl2(CO)2•2H2O],其结构如图所示。试从结构角度分析,CuCl的盐酸溶液可以吸收CO的原因是

(4)可以选用下面的一套装置___________(填标号)替换掉装置E和F。
A. | B. | C. | D. |

①安全漏斗中的水在本实验中的作用除与TiCl4反应外,还有
②滴定终点的判断方法是
③已知TiCl4的摩尔质量是190g/mol,则产品的纯度为
23-24高三下·重庆渝北·阶段练习
类题推荐
TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
回答下列问题:
(1)A装置仪器b的名称是_______ ,E装置中的试剂是_______ 。
(2)装置A中发生反应的离子方程式为_______ 。
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是_______ 。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为_______ 。
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是_______ 。
(6)利用如图装置测定所得TiCl4的纯度:取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl。

①安全漏斗在本实验中的作用除加水外,还有_______ ;
②滴定终点的判断方法是_______ ;
③产品的纯度为_______ (用含w、c和V的代数式表示)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)A装置仪器b的名称是
(2)装置A中发生反应的离子方程式为
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是
(6)利用如图装置测定所得TiCl4的纯度:取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl。

①安全漏斗在本实验中的作用除加水外,还有
②滴定终点的判断方法是
③产品的纯度为
TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
已知: TiCl4 易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
回答下列问题:
(1)装置D中仪器b的名称是___________ ,装置E中的试剂是___________ (填试剂名称)。
(2)装置B中长导管a的作用是___________ 。
(3)装置A中发生反应的离子方程式为___________ 。
(4)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是___________ 。
(5)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为___________ 。
(6)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是___________ 。
(7)利用如图装置测定所得TiCl4的纯度:取m g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转 入锥形瓶中,滴加几滴0.1mol·L-1 K2CrO4溶液作指示剂,用n mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液VmL。
已知:常温下,Ksp(AgCl)=1.8×10-10、 Ksp(Ag2CrO4)=1.1×10-12, Ag2CrO4 呈砖红色,TiCl4+(2+n)H2O= TiO2·nH2O↓+4HCl。
①安全漏斗在本实验中的作用除加水外,还有___________ ;
②滴定终点的判断方法是___________ ;
③产品的纯度为___________ (用含m、n和V的代数式表示)。

已知: TiCl4 易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置D中仪器b的名称是
(2)装置B中长导管a的作用是
(3)装置A中发生反应的离子方程式为
(4)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是
(5)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为
(6)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是
(7)利用如图装置测定所得TiCl4的纯度:取m g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转 入锥形瓶中,滴加几滴0.1mol·L-1 K2CrO4溶液作指示剂,用n mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液VmL。

已知:常温下,Ksp(AgCl)=1.8×10-10、 Ksp(Ag2CrO4)=1.1×10-12, Ag2CrO4 呈砖红色,TiCl4+(2+n)H2O= TiO2·nH2O↓+4HCl。
①安全漏斗在本实验中的作用除加水外,还有
②滴定终点的判断方法是
③产品的纯度为
TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
回答下列问题:
(1)A装置仪器b的名称是___________ ,E装置中的试剂是_________________ 。
(2)装置A中发生反应的离子方程式为________ 。
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是______________________________ 。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为:___ 。
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是______ 。
(6)利用如图装置测定所得TiCl4的纯度:

取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色, TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl
①滴定终点的判断方法是______________________ 。
②产品的纯度为___________ (用含w、c和V的代数式表示)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)A装置仪器b的名称是
(2)装置A中发生反应的离子方程式为
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为:
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是
(6)利用如图装置测定所得TiCl4的纯度:

取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色, TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl
①滴定终点的判断方法是
②产品的纯度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


