解答题-原理综合题 适中0.65 引用1 组卷105
甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。
(1)已知一定条件下,发生反应:




该条件下,水煤气(CO与H2的混合气体)转化成甲醇的热化学方程式是_______ 。
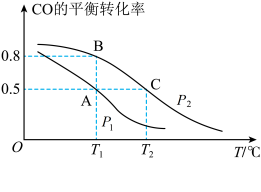
(2)工业上使用水煤气转化成甲醇,CO的平衡转化率与温度、压强的关系如图所示:
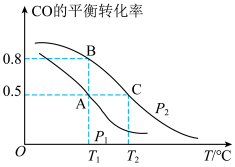
①要使A点变到B点除增大压强外还可以_______ 。
②A、C两点的平衡转化率相等的原因是_______ 。
③C点条件下假设压强为P2千帕,往容器内充入1molCO与2.5molH2发生反应。平衡时H2的体积分数是_______ 、Kp=_______ 。
(3)工业上也可以用CO2和H2合成甲醇:
 。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下。
。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下。
①若x=19.2,则α1=_______ 。
②下列说法正确的是_______ (填选项字母)。
A. 2c2<c3 B. z>2y,x=y C. p3<2p1 D. a1=a2
③若反应 在四种不同情况下的反应速率分别为:
在四种不同情况下的反应速率分别为:
A. B.
B. 
C. D.
D. 
该反应进行由慢到快的顺序为_______ (填选项字母)。
(1)已知一定条件下,发生反应:
该条件下,水煤气(CO与H2的混合气体)转化成甲醇的热化学方程式是
(2)工业上使用水煤气转化成甲醇,CO的平衡转化率与温度、压强的关系如图所示:

①要使A点变到B点除增大压强外还可以
②A、C两点的平衡转化率相等的原因是
③C点条件下假设压强为P2千帕,往容器内充入1molCO与2.5molH2发生反应。平衡时H2的体积分数是
(3)工业上也可以用CO2和H2合成甲醇:
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 3molH2(g) 1molCO2(g) | 1molCH3OH(g) 1molH2O(g) | 2molCH3OH(g) 2molH2O(g) | |
| 平衡数据 | c1 | c2 | c3 | |
| 反应的能量变化/kJ | x | y | z | |
| 体系压强/Pa | p1 | p2 | p3 | |
| 反应物转化率 | a1 | a2 | a3 | |
②下列说法正确的是
A. 2c2<c3 B. z>2y,x=y C. p3<2p1 D. a1=a2
③若反应
A.
C.
该反应进行由慢到快的顺序为
23-24高二下·湖北·阶段练习
类题推荐
研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g) H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________ 。
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率( )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率 =
=________ %。
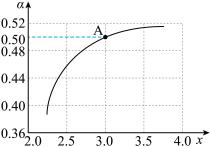
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______ (kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________ 。
②下列说法正确的是________ (填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____ [K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____ c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)
 H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1II:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(

③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:容器 | 甲 | 乙 | 丙 | |
起始反应物投入量 | 3mol H2(g) 1mol CO2(g) | 1mol CH3OH(g) 1mol H2O(g) | 2mol CH3OH(g) 2mol H2O(g) | |
平衡数据 | c(CH3OH)/mol·L-1 | c1 | c2 | c3 |
反应的能量变化kJ | x | y | z | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
②下列说法正确的是
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网