解答题-工业流程题 较易0.85 引用1 组卷96
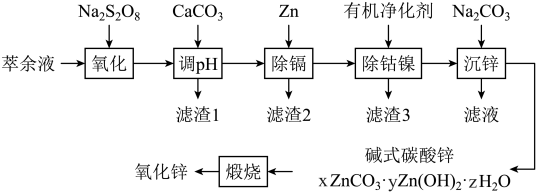
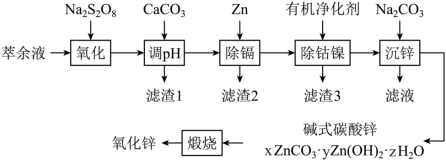
湿法炼锌综合回收系统产出的萃余液中含有Na2SO4、ZnSO4、H2SO4,还含有Mn2+、Co2+、Ni2+、Cd2+、Fe2+、Al3+等,一种将萃余液中有价离子分步分离、富集回收的工艺流程如下:
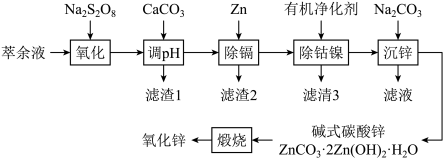
回答下列问题:
(1)“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为_______ 。
(2)“调pH”时,所得“滤渣1”中除含有MnO2和 外,还有
外,还有_______ 。
(3)“除镉”时,发生反应的类型为_______ 。
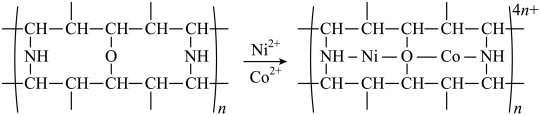
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:
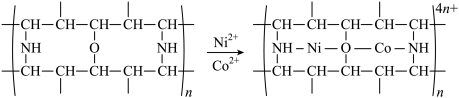
反应时,接受电子对的一方是_______ ;Ni2+价电子排布式为_______ 。
(5)“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为_______ 。
(6)“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8,从而实现原料的循环利用,该电解过程中总反应的化学方程式为_______ 。
(7)氧化锌有多种晶体结构,其中一种晶胞结构及晶胞参数如图所示。已知阿伏加德罗常数的值为NA,则该氧化锌晶体的密度为_______ g⋅cm-3(列出计算式即可)。


回答下列问题:
(1)“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为
(2)“调pH”时,所得“滤渣1”中除含有MnO2和
(3)“除镉”时,发生反应的类型为
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:

反应时,接受电子对的一方是
(5)“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为
(6)“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8,从而实现原料的循环利用,该电解过程中总反应的化学方程式为
(7)氧化锌有多种晶体结构,其中一种晶胞结构及晶胞参数如图所示。已知阿伏加德罗常数的值为NA,则该氧化锌晶体的密度为

23-24高三上·河南信阳·阶段练习
类题推荐
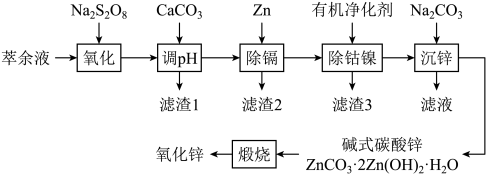
我国是最早制得和使用金属锌的国家。某湿法炼锌的萃余液中含有H+、Na+、Zn2+、Fe2+、Mn2+、Co2+、Cd2+、Ni2+、 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
回答下列问题:
(1)按照核外电子排布可把元素周期表分成5个区,Zn元素在_______ 区。
(2)“氧化”时,pH=1,所用氧化剂过二硫酸钠(Na2S2O8)中硫元素化合价为_______ ,Mn2+被氧化为MnO2,Fe2+与Na2S2O8反应的离子方程式是_______ 。
(3)“调pH”时,pH=4,所得滤渣1中除含有MnO2外,还有_______ 。
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理可表示为: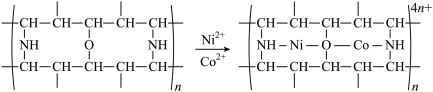 ,Co2+、Ni2+能发生上述转化而Zn2+不能,推测可能的原因为
,Co2+、Ni2+能发生上述转化而Zn2+不能,推测可能的原因为_____ 。
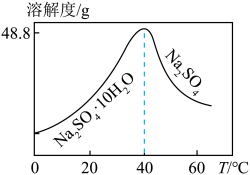
(5)“沉锌” 所得滤液经处理可得Na2SO4溶液,已知Na2SO4的溶解度随温度变化如图所示,由该溶液制备无水Na2SO4的操作为_____ 、洗涤、干燥。_____ 。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| Ksp近似值 | 10-38 | 10-17 | 10-17 |
(1)按照核外电子排布可把元素周期表分成5个区,Zn元素在
(2)“氧化”时,pH=1,所用氧化剂过二硫酸钠(Na2S2O8)中硫元素化合价为
(3)“调pH”时,pH=4,所得滤渣1中除含有MnO2外,还有
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理可表示为:
 ,Co2+、Ni2+能发生上述转化而Zn2+不能,推测可能的原因为
,Co2+、Ni2+能发生上述转化而Zn2+不能,推测可能的原因为(5)“沉锌” 所得滤液经处理可得Na2SO4溶液,已知Na2SO4的溶解度随温度变化如图所示,由该溶液制备无水Na2SO4的操作为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

 ”,则其中硫元素化合价为
”,则其中硫元素化合价为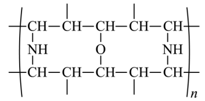
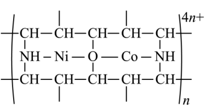 ,该有机大分子聚合物属于
,该有机大分子聚合物属于

