解答题-原理综合题 较难0.4 引用2 组卷411
氢气的制取、 的减排和
的减排和 资源利用是当前研究的热点。
资源利用是当前研究的热点。
(1) 热解制氢的反应原理为:
热解制氢的反应原理为: 、
、 。常压下,按
。常压下,按 投料,并用
投料,并用 稀释,将混合气以一定流速通过石英管反应器,测得不同温度下
稀释,将混合气以一定流速通过石英管反应器,测得不同温度下 和
和 体积分数如下:
体积分数如下:
在950-1150°C范围内(保持其他条件不变), 的体积分数随温度升高的变化是
的体积分数随温度升高的变化是_______ (填“先升高后降低”、“先降低后升高”或“不变”),其原因是_______ 。
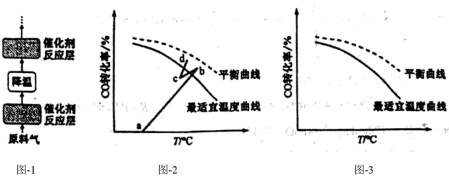
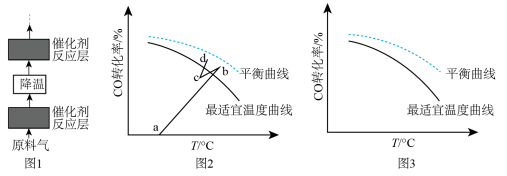
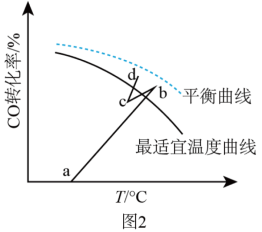
(2)水煤气变换制氢反应 是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。在催化剂活性温度范围内,图2中
是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。在催化剂活性温度范围内,图2中 段对应降温操作的过程,实现该过程的一种操作方法是
段对应降温操作的过程,实现该过程的一种操作方法是_______ 。若采用喷入冷水(蒸气)的方式降温,在图3中作出平衡转化率随温度变化的曲线_______ 。 电池是固定
电池是固定 的路径之一、
的路径之一、 电池以单质
电池以单质 为负极,电池反应的产物为
为负极,电池反应的产物为 和单质碳,研究表明,该电池中
和单质碳,研究表明,该电池中 通过4步形成
通过4步形成 ;
;
I.
II.
III._______
N.
则步骤III反应式为_______ 。
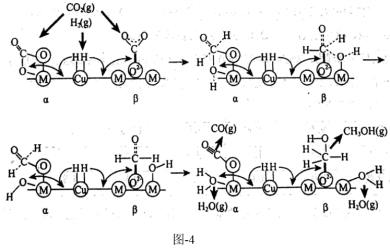
(4)铜基催化剂 (
( 为
为 、
、 、
、 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图-4所示。
加氢制甲醇常用的催化剂,部分合成路线如图-4所示。 位点、氧化物载体位点),
位点、氧化物载体位点), 分别在中碱位(
分别在中碱位( )、强碱位(
)、强碱位( )吸附发生反应。
)吸附发生反应。
①请写出中碱位( )上发生反应的总化学方程式
)上发生反应的总化学方程式_______ 。
②上述 加氢制甲醇的过程可简单描述为
加氢制甲醇的过程可简单描述为_______ 。
(1)
| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
| 0.5 | 1.5 | 3.6 | 5.5 | 8.5 | |
| 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
(2)水煤气变换制氢反应
I.
II.
III._______
N.
则步骤III反应式为
(4)铜基催化剂
①请写出中碱位(
②上述
23-24高三下·江苏镇江·阶段练习
类题推荐
水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:

该反应分两步完成:




请回答:
(1)
_______  。
。
(2)恒定总压 和水碳比[
和水碳比[ ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
①在条件1下,水煤气变换反应的平衡常数
___________ 。
②对比条件1,条件2中 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式____ 。
(3)下列说法正确的是______。
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。______ 。
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出 平衡转化率随温度变化的曲线
平衡转化率随温度变化的曲线____ 。
(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是________ 。
水煤气变换反应:
该反应分两步完成:
请回答:
(1)
(2)恒定总压
条件1 | 0.40 | 0.40 | 0 |
条件2 | 0.42 | 0.36 | 0.02 |
②对比条件1,条件2中
(3)下列说法正确的是______。
| A.通入反应器的原料气中应避免混入 |
| B.恒定水碳比 |
| C.通入过量的水蒸气可防止 |
| D.通过充入惰性气体增加体系总压,可提高反应速率 |
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出
(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是
水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:

该反应分两步完成:




请回答:
(1)
_____________  。
。
(2)恒定总压1.70MPa和水碳比[ ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
①在条件1下,水煤气变换反应的平衡常数K=___________ 。
②对比条件1,条件2中 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式___________ 。
(3)下列说法正确的是 。
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。_____________ 。
C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线_____________ 。________________ 。
水煤气变换反应:
该反应分两步完成:
请回答:
(1)
(2)恒定总压1.70MPa和水碳比[
|
|
| |
条件1 | 0.40 | 0.40 | 0 |
条件2 | 0.42 | 0.36 | 0.02 |
②对比条件1,条件2中
(3)下列说法正确的是 。
| A.通入反应器的原料气中应避免混入 |
| B.恒定水碳比[ |
| C.通入过量的水蒸气可防止 |
| D.通过充入惰性气体增加体系总压,可提高反应速率 |
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。

C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线

主要成分为 的工业废气的回收利用有重要意义。
的工业废气的回收利用有重要意义。
Ⅰ.可利用 热分解制备
热分解制备
(1)已知下列反应的热化学方程式:
①
②
③
计算 热分解反应④
热分解反应④
___________  。
。
Ⅱ.可利用 与
与 反应制备
反应制备
(2)根据文献,将 和
和 的混合气体导入石英管反应器热解,发生反应:
的混合气体导入石英管反应器热解,发生反应:
反应Ⅰ:
反应Ⅱ:
总反应:
投料按体积之比 ,并用N2稀释;甲烷和硫化氢的混合气体以一定流速通过石英管;常压、不同温度下反应相同时间后,测得和体积分数如下表:
,并用N2稀释;甲烷和硫化氢的混合气体以一定流速通过石英管;常压、不同温度下反应相同时间后,测得和体积分数如下表:
活化能:反应Ⅰ___________ 反应Ⅱ(填“>”“<”或“=”)。
②在 、常压下,保持通入
、常压下,保持通入 体积分数
体积分数 不变,提高投料比
不变,提高投料比 ,
, 的转化率不变,其原因是
的转化率不变,其原因是___________ 。
(3)实验测定,在 范围内(其他条件不变),
范围内(其他条件不变), 的体积分数随温度升高先增大而后减小,其原因可能是
的体积分数随温度升高先增大而后减小,其原因可能是___________ 。
(4)理论计算表明,压强为 ,原料初始组成
,原料初始组成 ,只发生反应:
,只发生反应: ,达到平衡时四种组分的物质的量分数随温度T的变化如下图所示。
,达到平衡时四种组分的物质的量分数随温度T的变化如下图所示。
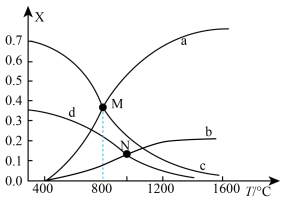
① 图中表示H2S、CS2变化的曲线分别是___________ 、___________ 。
反应: 的
的
___________ 0(填“大于”或“小于”)。
② 时,该反应的
时,该反应的
___________ 。
Ⅲ.可利用H2S间接制备单质硫
(5)先用足量NaOH溶液吸收H2S气体,再将吸收后的溶液用如下图所示的装置电解,碱性条件下,S2-被氧化生成 。取阳极区电解后的溶液,加入硫酸可得到单质硫。
。取阳极区电解后的溶液,加入硫酸可得到单质硫。
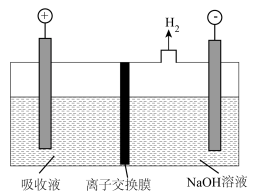
①图中隔膜应使用___________ (填“阳”或“阴”)离子交换膜。
②阳极电极反应式为___________ 。
③若电解前阳极室和阴极室溶液质量相同,当标准状况下收集到22.4L氢气时,则理论上阴极室与阳极室溶液质量之差为___________ g。
Ⅰ.可利用
(1)已知下列反应的热化学方程式:
①
②
③
计算
Ⅱ.可利用
(2)根据文献,将
反应Ⅰ:
反应Ⅱ:
总反应:
投料按体积之比
| 温度/ | 950 | 1000 | 1050 | 1100 | 1150 |
| 0.5 | 1.5 | 3.6 | 5.5 | 8.5 | |
| 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
②在
(3)实验测定,在
(4)理论计算表明,压强为

① 图中表示H2S、CS2变化的曲线分别是
反应:
②
Ⅲ.可利用H2S间接制备单质硫
(5)先用足量NaOH溶液吸收H2S气体,再将吸收后的溶液用如下图所示的装置电解,碱性条件下,S2-被氧化生成

①图中隔膜应使用
②阳极电极反应式为
③若电解前阳极室和阴极室溶液质量相同,当标准状况下收集到22.4L氢气时,则理论上阴极室与阳极室溶液质量之差为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


