解答题-原理综合题 适中0.65 引用2 组卷283
H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。____________ (填序号)。
a.单质硫为黄色固体
b.脱硫反应为
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_____________ 。
(2)电化学溶解—沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
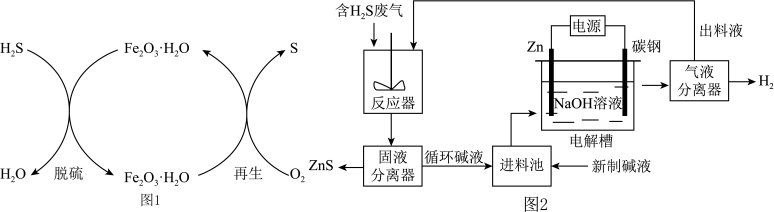
已知:Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以 形式存在。
形式存在。
①锌棒连接直流电源的___________ (填“正极”或“负极”)。
②反应器中反应的离子方程式为_________ 。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:________ 。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ⅱ.将带有沉淀的滤纸加入盛有15mL0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10min后,用少量水冲洗瓶壁和瓶塞。(已知: )
)
ⅲ.用0.1mol/LNa2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知: )
)
①滴定终点的现象是_______ 。
②若消耗Na2S2O3标准液的体积为20mL,则煤气中H2S的含量为_______ mg/m3。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
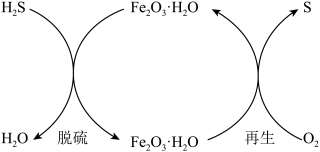
a.单质硫为黄色固体
b.脱硫反应为
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是
(2)电化学溶解—沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。

已知:Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以
①锌棒连接直流电源的
②反应器中反应的离子方程式为
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ⅱ.将带有沉淀的滤纸加入盛有15mL0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10min后,用少量水冲洗瓶壁和瓶塞。(已知:
ⅲ.用0.1mol/LNa2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:
①滴定终点的现象是
②若消耗Na2S2O3标准液的体积为20mL,则煤气中H2S的含量为
23-24高三下·北京海淀·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网