解答题-原理综合题 较难0.4 引用1 组卷56
碘及碘的化合物在生产、生活中有广泛应用。在KI溶液中滴加少量 溶液发生有关反应如下:
溶液发生有关反应如下:
①
 ;
;
② (棕黄色)
(棕黄色)  。
。
回答下列问题:
(1)在碘水中加入 ,萃取、分液得到紫红色液体和水层(M)。
,萃取、分液得到紫红色液体和水层(M)。
①由此可知, 的溶解度:四氯化碳>水,从结构角度分析其原因:
的溶解度:四氯化碳>水,从结构角度分析其原因:___________ ;
②检验M中是否有 的试剂是
的试剂是___________ 。
(2)

___________ 。
(3)一定温度下,在 溶液中加入适量的
溶液中加入适量的 ,只发生反应
,只发生反应
 。测得
。测得 与温度(T)关系如图所示。
与温度(T)关系如图所示。
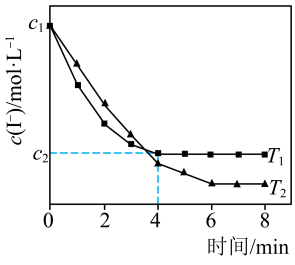
①
___________ (填“>”“<”或“=”)0。
② 温度下,0~4min时间段内
温度下,0~4min时间段内 平均速率
平均速率 为
为___________  。
。
(4)某温度下,起始在反应器中加入 溶液和
溶液和 固体(忽略溶液体积变化),发生上述①②反应。测得
固体(忽略溶液体积变化),发生上述①②反应。测得 、
、 、
、 的平衡浓度与起始
的平衡浓度与起始 关系如图所示。
关系如图所示。
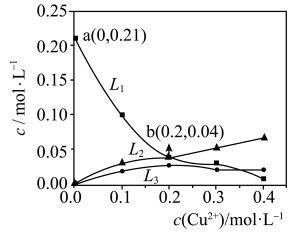
①起始 时,
时, 的平衡转化率为
的平衡转化率为___________ 。
②该温度下, 的平衡常数K=
的平衡常数K=___________ 。
(5) 的氧化性比
的氧化性比 的强,但是KI和
的强,但是KI和 发生复分解反应,不发生氧化还原反应,其原因是
发生复分解反应,不发生氧化还原反应,其原因是___________ 。
①
②
回答下列问题:
(1)在碘水中加入
①由此可知,
②检验M中是否有
(2)
(3)一定温度下,在

①
②
(4)某温度下,起始在反应器中加入

①起始
②该温度下,
(5)
23-24高三上·江西抚州·阶段练习
类题推荐
碘及碘的化合物在生产、生活中有广泛应用。某温度下,在反应器中起始加入0.21 KI溶液,加入
KI溶液,加入 ,发生反应①和反应②。测得
,发生反应①和反应②。测得 、
、 、
、 的平衡浓度与起始
的平衡浓度与起始 关系如图所示。
关系如图所示。
①
② (棕黄色)
(棕黄色)
下列叙述正确的是

①
②
下列叙述正确的是
| A.反应①中还原剂、氧化剂的物质的量之比为2∶1 |
| B. |
| C.起始 |
| D.该温度下, |
氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)已知在298K和101kPa条件下,有如下反应:
反应①:C(s)+O2(g)=CO2(g)ΔH1=-393.5kJ·mol-1
反应②:N2(g)+O2(g)=2NO(g)ΔH2=+180.5kJ·mol-1
若反应 CO2(g)+
CO2(g)+ N2(g)⇌
N2(g)⇌ C(s)+NO(g)的活化能为akJ·mol-1,则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为
C(s)+NO(g)的活化能为akJ·mol-1,则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为______________ kJ·mol-1。
(2)在常压下,已知反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g)ΔH(298K)=-113.0kJ·mol-1,ΔS(298K)=-145.3J/(mol·K),据此可判断该反应在常温下__________ (填“能”或“不能”)自发进行。
(3)向容积为2L的真空密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g),NO和N2的物质的量变化如表所示,在T1℃、T2℃分别到达平衡时容器的总压强分别为p1kPa、p2kPa。
①0~10min内,以NO表示的该反应速率v(NO)=______________ kPa·min-1。
②第15min后,温度调整到T2,数据变化如表所示,则p1_______ p2(填“>”、“<”或“=”)。
(4)为探究温度及不同催化剂对反应2NO(g)+2CO(g) ⇌N2(g)+2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图所示:在催化剂乙作用下,图中M点对应的速率(对应温度400℃)v正_______ v逆(填“>”、“<”或“=”),其理由为_______________________________________ 。

(5)已知,常温下H2S、H2CO3的电离常数如下表
常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是_______ 。其原因是_____________________________ 。
(1)已知在298K和101kPa条件下,有如下反应:
反应①:C(s)+O2(g)=CO2(g)ΔH1=-393.5kJ·mol-1
反应②:N2(g)+O2(g)=2NO(g)ΔH2=+180.5kJ·mol-1
若反应
(2)在常压下,已知反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g)ΔH(298K)=-113.0kJ·mol-1,ΔS(298K)=-145.3J/(mol·K),据此可判断该反应在常温下
(3)向容积为2L的真空密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g),NO和N2的物质的量变化如表所示,在T1℃、T2℃分别到达平衡时容器的总压强分别为p1kPa、p2kPa。
| 物质的量/mol | T1℃ | T2℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~10min内,以NO表示的该反应速率v(NO)=
②第15min后,温度调整到T2,数据变化如表所示,则p1
(4)为探究温度及不同催化剂对反应2NO(g)+2CO(g) ⇌N2(g)+2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图所示:在催化剂乙作用下,图中M点对应的速率(对应温度400℃)v正

(5)已知,常温下H2S、H2CO3的电离常数如下表
| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

 B.
B. C.
C.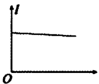 D.
D.


