填空题 适中0.65 引用2 组卷70
电解质水溶液中存在电离平衡,水解平衡、沉淀溶解平衡。请回答下列问题:
(1)常温下,部分弱酸的电离平衡常数如表:
①等浓度 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是___________ (写化学式)。
②等浓度的 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为___________ 。
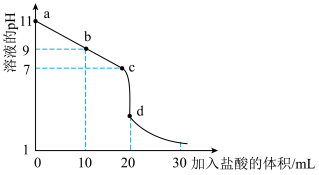
(2)室温下,用 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。___________ (填“甲基橙”或“酚酞”)作指示剂。
②室温下, 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为___________ 
③b点所示的溶液中
___________ (用溶液的其它离子浓度表示)。
(3)工业上向锅炉里注入所得到的 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。当把水垢中 完全转化时,混合溶液中的
完全转化时,混合溶液中的 ,则
,则
___________  (保留小数点后一位)。
(保留小数点后一位)。
已知: ,
,
(1)常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | |||
| 电离平衡常数 |
②等浓度的
(2)室温下,用
②室温下,
③b点所示的溶液中
(3)工业上向锅炉里注入所得到的
已知:
23-24高二下·江西上饶·开学考试
类题推荐
根据水溶液中的离子平衡有关知识回答下列问题:
(1)纯水在100℃时, ,该温度下
,该温度下 的NaOH溶液中,由水电离出的
的NaOH溶液中,由水电离出的
_______  。
。
(2)常温下,将 的稀盐酸与
的稀盐酸与 的NaOH溶液混合,所得溶液的pH为1,则
的NaOH溶液混合,所得溶液的pH为1,则
_______ (溶液体积变化忽略不计)。
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,等浓度的a:NaCN溶液、b: 溶液和c:
溶液和c: 溶液,三种溶液的pH由大到小的顺序为
溶液,三种溶液的pH由大到小的顺序为_______ 。(大小用a、b、c表示)
②向NaCN溶液中通入少量的 ,发生反应的化学方程式为
,发生反应的化学方程式为_______ 。
(4)常温下,用0.1000 mol∙L−1的NaOH溶液滴定20.00mL0.1000 mol∙L−1的 溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:
溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:

①该滴定过程应该选择_______ (填“酚酞”或“甲基橙”)作指示剂。
②a_______ 20mL(填“>”“<”或“=”)。
③C点溶液中离子浓度由大到小的顺序为_______ 。
(1)纯水在100℃时,
(2)常温下,将
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | |
②向NaCN溶液中通入少量的
(4)常温下,用0.1000 mol∙L−1的NaOH溶液滴定20.00mL0.1000 mol∙L−1的

①该滴定过程应该选择
②a
③C点溶液中离子浓度由大到小的顺序为
平衡思想是化学研究的一个重要观念。电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①常温下,物质的量浓度相同的三种溶液:a. 、b.
、b. 、c.
、c. ,
, 由大到小的顺序是
由大到小的顺序是_______ (填序号)。
②室温下, 溶液
溶液 ,用离子方程式表示溶液呈碱性的原因是
,用离子方程式表示溶液呈碱性的原因是_______ ,溶液中
_______ 。
(2)室温下,用 盐酸滴定
盐酸滴定 的氨水,滴定曲线如图所示。
的氨水,滴定曲线如图所示。
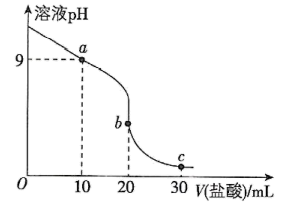
①a点所示的溶液中粒子浓度由大到小的顺序依次为_______ 
_______  。
。
②c点所示的溶液中
_______  (忽略溶液体积的变化)。
(忽略溶液体积的变化)。
(3)室温下, 、
、 的电离平衡常数分别为
的电离平衡常数分别为 、
、 。下列溶液混合后,
。下列溶液混合后, 大于7的是
大于7的是_______ (填序号)。
① 的盐酸和
的盐酸和 的
的 溶液等体积混合
溶液等体积混合
②等浓度、等体积 溶液、
溶液、 溶液混合
溶液混合
③ 的盐酸和
的盐酸和 的氨水等体积混合
的氨水等体积混合
④ 的醋酸溶液和
的醋酸溶液和 溶液等体积混合
溶液等体积混合
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | |||
| 电离常数(25℃) |
②室温下,
(2)室温下,用

①a点所示的溶液中粒子浓度由大到小的顺序依次为
②c点所示的溶液中
(3)室温下,
①
②等浓度、等体积
③
④
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______ c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________ (填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为______________ 。
④将少量CO2通入NaCN溶液,反应的离子方程式是____ 。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_____________ ,溶液中 =
=___________ 。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
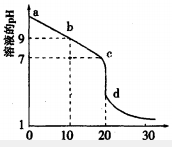
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________ 。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____ (用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____ 。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____ mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中 =
=___________ (保留三位有效数字)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)
②常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为
④将少量CO2通入NaCN溶液,反应的离子方程式是
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


