填空题 适中0.65 引用1 组卷158
Burns和Dainton研究了反应Cl2(g)+CO(g) COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
(1)该反应可认为经过以下反应历程:
第一步:Cl2 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl+CO COCl 快速平衡
COCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
下列表述正确的是______(填标号)。
(2)在某温度下进行实验,测得各组分初浓度和反应初速度如下:
CO的反应级数m=______ ,当实验4进行到某时刻,测得c(Cl2)=0.010mol·L-1,则此时的反应速率v=______ mol·L-1·s-1(已知: ≈0.32)。
≈0.32)。
(1)该反应可认为经过以下反应历程:
第一步:Cl2
第二步:Cl+CO
第三步:COCl+Cl2→COCl2+Cl 慢反应
下列表述正确的是______(填标号)。
| A.COCl属于反应的中间产物 |
| B.第一步和第二步的活化能较高 |
| C.决定总反应快慢的是第三步 |
| D.第三步的有效碰撞频率较大 |
| 实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.050 | 0.100 | 4.26×10-3 |
| 3 | 0.100 | 0.200 | 2.4×10-2 |
| 4 | 0.050 | 0.050 | 2.13×10-3 |
2024高三下·全国·专题练习
类题推荐
Burns和Dainton研究了反应Cl2(g)+CO(g) COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。该反应可认为经过以下反应历程:下列表述错误的是
COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。该反应可认为经过以下反应历程:下列表述错误的是
第一步:Cl2 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl+CO COCl 快速平衡
COCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
第一步:Cl2
第二步:Cl+CO
第三步:COCl+Cl2→COCl2+Cl 慢反应
| A.COCl属于反应的中间产物 | B.第一步和第二步的活化能较低 |
| C.决定总反应快慢的是第三步 | D.第三步的有效碰撞频率较大 |
光气(COCl2)在塑料、制药等工业生产中有许多用途,其化学性质不稳定,遇水迅速产生两种酸性气体。回答下列问题:
(1)少量COCl2可用烧碱溶液吸收,发生反应的离子方程式为________ 。
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g) COCl2(g) ∆H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
COCl2(g) ∆H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
CH4(g)+2O2(g)==CO2(g)+2H2O(l) ∆H1=-890.3 kJ·mol-1
2H2(g)+O2 (g)==2H2O(l) ∆H2=-571.6 kJ·mol-1
2CO(g)+O2 (g)==2CO2(g) ∆H3=-566 kJ·mol-1
则CH4与CO2催化重整反应生成CO和H2的热化学方程式为_____ 。
(3)在T ℃时,向盛有活性炭的5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示:
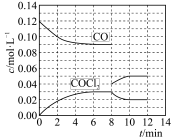
①反应在第6 min时的平衡常数为___ ,第8 min时改变的条件是____ 。
②在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将___ (填“增大”“不变”或“减小”),原因是_____ 。
(4)Burns和Dainton研究了反应Cl2(g)+CO(g) COCl2(g)的动力学,获得其速率方程v = k [c(Cl2)]3/2 [c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v = k [c(Cl2)]3/2 [c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
①该反应可认为经过以下反应历程:
第一步:Cl2⇌2Cl 快速平衡
第二步:Cl + CO⇌COCl 快速平衡
第三步:COCl + Cl2 —→COCl2 + Cl 慢反应
下列表述正确的是____ (填标号)。
A.COCl属于反应的中间产物 B.第一步和第二步的活化能较高
C.决定总反应快慢的是第三步 D.第三步的有效碰撞频率较大
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
CO的反应级数m =___ ,当实验4进行到某时刻,测得c(Cl2) = 0.010 mol·L-1,则此时的反应速率v =___ mol·L-1·s-1(已知: ≈ 0.32)。
≈ 0.32)。
(1)少量COCl2可用烧碱溶液吸收,发生反应的离子方程式为
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g)
 COCl2(g) ∆H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
COCl2(g) ∆H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:CH4(g)+2O2(g)==CO2(g)+2H2O(l) ∆H1=-890.3 kJ·mol-1
2H2(g)+O2 (g)==2H2O(l) ∆H2=-571.6 kJ·mol-1
2CO(g)+O2 (g)==2CO2(g) ∆H3=-566 kJ·mol-1
则CH4与CO2催化重整反应生成CO和H2的热化学方程式为
(3)在T ℃时,向盛有活性炭的5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示:

①反应在第6 min时的平衡常数为
②在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将
(4)Burns和Dainton研究了反应Cl2(g)+CO(g)
①该反应可认为经过以下反应历程:
第一步:Cl2⇌2Cl 快速平衡
第二步:Cl + CO⇌COCl 快速平衡
第三步:COCl + Cl2 —→COCl2 + Cl 慢反应
下列表述正确的是
A.COCl属于反应的中间产物 B.第一步和第二步的活化能较高
C.决定总反应快慢的是第三步 D.第三步的有效碰撞频率较大
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
| 实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.050 | 0.100 | 4.26×10-3 |
| 3 | 0.100 | 0.200 | 2.4×10-2 |
| 4 | 0.050 | 0.050 | 2.13×10-3 |
光气(COC12)通常为无色气体,化学性质不稳定,遇水迅速水解。是有机合成、农药、药物、染料及其他化工制品的中间体。
(1)请写出COCl2分子的电子式_______ 。
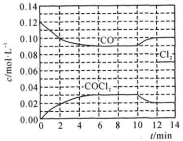
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g)⇌COCl2(g) △H =-108 kJ/mol。在T℃时,向5L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度随时间变化如图所示。其他条件不变时,第10 min时改变某个条件,使平衡发生移动,在12 min时建立新的平衡,则改变的条件为_______ ,判断的理由是_______ 。
(3)已知Cl2 (g)+CO(g)⇌COCl2 (g)的速率方程v=k·[c(C12)]3/2·c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
①该反应可认为经过以下反应历程:
第一步:Cl2⇌2Cl 快速平衡
第二步:Cl+CO⇌COCl 快速平衡
第三步:COCl+Cl2→COCl2 +Cl 慢反应
下列表述正确的是_______ (填标号)。
A.只有COC1是反应的中间产物 B.第三步反应的活化能最大
C.升高温度,k增大 D.Cl2和CO分子间的碰撞都是有效碰撞
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
m=_______ ,当实验1进行到某时刻,测得c(Cl2)=0.010 mol/L,则此时的反应速率v=_______ mol·L-1·s-l(已知: )。
)。
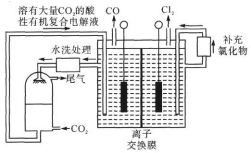
(4)采用电化学方法制备光气合成原料气CO和Cl2的装置如图所示。阴极电极反应为_______ 。
(1)请写出COCl2分子的电子式
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g)⇌COCl2(g) △H =-108 kJ/mol。在T℃时,向5L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度随时间变化如图所示。其他条件不变时,第10 min时改变某个条件,使平衡发生移动,在12 min时建立新的平衡,则改变的条件为

(3)已知Cl2 (g)+CO(g)⇌COCl2 (g)的速率方程v=k·[c(C12)]3/2·c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
①该反应可认为经过以下反应历程:
第一步:Cl2⇌2Cl 快速平衡
第二步:Cl+CO⇌COCl 快速平衡
第三步:COCl+Cl2→COCl2 +Cl 慢反应
下列表述正确的是
A.只有COC1是反应的中间产物 B.第三步反应的活化能最大
C.升高温度,k增大 D.Cl2和CO分子间的碰撞都是有效碰撞
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
| 实验序号 | c(Cl2 )/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | 0.100 | 0.100 | 1. 2×10-2 |
| 2 | 0.100 | 0.200 | 2. 4×10-2 |
m=
(4)采用电化学方法制备光气合成原料气CO和Cl2的装置如图所示。阴极电极反应为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


